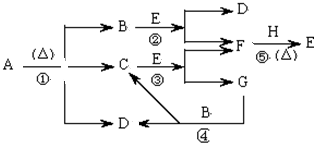
题目内容
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质.为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作.
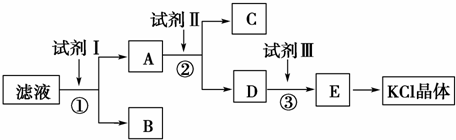
(1)为检验起始滤液中的Cl-,所用试剂除稀HNO3,还应有 (填化学式)
(2)试剂Ⅰ、Ⅱ、Ⅲ的化学式分别为 、 、
(3)步骤①和②中,所用的玻璃仪器除胶头滴管,还应有
(4)步骤①中,判断试剂Ⅰ已加入过量的方法是:
(5)某同学根据最终所得KCl晶体和原样品的质量求算出氯化钾样品的纯度,你认为其结果是否可靠?并说明理 (不考虑实验误差): .

(1)为检验起始滤液中的Cl-,所用试剂除稀HNO3,还应有
(2)试剂Ⅰ、Ⅱ、Ⅲ的化学式分别为
(3)步骤①和②中,所用的玻璃仪器除胶头滴管,还应有
(4)步骤①中,判断试剂Ⅰ已加入过量的方法是:
(5)某同学根据最终所得KCl晶体和原样品的质量求算出氯化钾样品的纯度,你认为其结果是否可靠?并说明理 (不考虑实验误差):
考点:无机物的推断
专题:推断题
分析:滤液中含有KCl、K2CO3、K2SO4,向滤液中加入过量BaCl2溶液,发生反应CO32-+Ba2+=BaCO3↓、SO42-+Ba2+=BaSO4↓,得到固体B为BaCO3、BaSO4,滤液中含有KCl、BaCl2,向滤液中加入过量K2CO3,除去过量的钡离子,得到固体C为BaCO3,D中溶质为K2CO3和KCl,然后向溶液中加入过量HCl,发生反应 CO32-+2H+=H2O+CO2↑,然后蒸发溶液,溶液中HCl挥发,所以最终得到KCl晶体,再结合题目分析解答.
解答:
解:滤液中含有KCl、K2CO3、K2SO4,向滤液中加入过量BaCl2溶液,发生反应CO32-+Ba2+=BaCO3↓、SO42-+Ba2+=BaSO4↓,得到固体B为BaCO3、BaSO4,滤液中含有KCl、BaCl2,向滤液中加入过量K2CO3,除去过量的钡离子,得到固体C为BaCO3,D中溶质为K2CO3和KCl,然后向溶液中加入过量HCl,发生反应 CO32-+2H+=H2O+CO2↑,然后蒸发溶液,溶液中HCl挥发,所以最终得到KCl晶体,
(1)为检验起始滤液中的Cl-,所用试剂除稀HNO3,还应加入Ba(NO3)2除去CO32-、SO42-的干扰,然后加入硝酸银检验氯离子,如果溶液中产生白色沉淀,说明含有氯离子,故答案为:Ba(NO3)2、AgNO3;
(2)通过以上分析知,I是BaCl2,II是K2CO3,III是HCl,故答案为:BaCl2;K2CO3;HCl;
(3)步骤①和②采用过滤的方法分离固体和溶液,所用的玻璃仪器除胶头滴管,还应有盛放溶液的烧杯、起过滤作用的漏斗、起引流作用的玻璃棒,
故答案为:烧杯、玻璃棒、漏斗;
(4)如果除杂剂过量,则滤液中含有钡离子,再加入氯化钡溶液不再产生沉淀,所以其检验方法是:取少量滤液A加入试剂Ⅰ,若无沉淀,则表明已过量,
故答案为:取少量滤液A加入试剂Ⅰ,若无沉淀,则表明已过量;
(5)除杂过程中K2CO3、K2SO4中的K元素都转化为KCl,所以该说法不可靠,故答案为:不可靠,所得KCl晶体并非完全来自原样品.
(1)为检验起始滤液中的Cl-,所用试剂除稀HNO3,还应加入Ba(NO3)2除去CO32-、SO42-的干扰,然后加入硝酸银检验氯离子,如果溶液中产生白色沉淀,说明含有氯离子,故答案为:Ba(NO3)2、AgNO3;
(2)通过以上分析知,I是BaCl2,II是K2CO3,III是HCl,故答案为:BaCl2;K2CO3;HCl;
(3)步骤①和②采用过滤的方法分离固体和溶液,所用的玻璃仪器除胶头滴管,还应有盛放溶液的烧杯、起过滤作用的漏斗、起引流作用的玻璃棒,
故答案为:烧杯、玻璃棒、漏斗;
(4)如果除杂剂过量,则滤液中含有钡离子,再加入氯化钡溶液不再产生沉淀,所以其检验方法是:取少量滤液A加入试剂Ⅰ,若无沉淀,则表明已过量,
故答案为:取少量滤液A加入试剂Ⅰ,若无沉淀,则表明已过量;
(5)除杂过程中K2CO3、K2SO4中的K元素都转化为KCl,所以该说法不可靠,故答案为:不可靠,所得KCl晶体并非完全来自原样品.
点评:本题以混合物的分离和提纯为载体考查了无机物推断,明确物质的性质是解本题关键,根据物质之间的反应、离子的检验方法、物质分离和提纯的方法等知识点来分析解答,难点是除杂剂的选取及滴加顺序,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列溶液中的Cl-浓度与50mL 1mol/L的AlCl3 溶液中Cl-的浓度相等的是( )
| A、0.3mol NaCl 溶于100mL水中 |
| B、75mL 1.5mol/L的CaCl2 |
| C、500mL 溶液中含3mol的KCl |
| D、150mL 1mol/L的 NaCl |
在AB型双核离子化合物中,An+和Bn-两种离子的核外电子数之和为20,可知A、B两元素在元素周期表中其周期的位置是( )
| A、可能都在第2周期 |
| B、若A在第3周期、则B在第4周期 |
| C、可能都在第3周期 |
| D、若A在第3周期、则B在第2周期 |
下列溶液中,跟100mL 0.15mol/LNa2SO4溶液所含的SO42-物质的量浓度相同的是( )
| A、200 mL 0.15 mol/L MgSO4 溶液 |
| B、50 mL 0.05 mol/L Al2(SO4)3溶液 |
| C、150 mL 1 mol/L Na2SO4 溶液 |
| D、300 mL 0.5 mol/L CuSO4 溶液 |
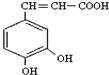 )也叫3,4-二羟基桂皮酸,它存在于许多种药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效.
)也叫3,4-二羟基桂皮酸,它存在于许多种药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效. 已知2A2(g)+B2(g)?2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为wmol/L,放出热量Q2kJ.
已知2A2(g)+B2(g)?2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为wmol/L,放出热量Q2kJ.