题目内容
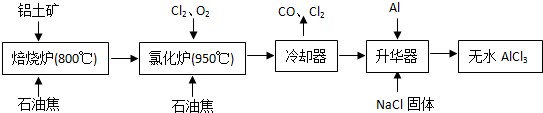
无水AlCl3易升华,可用作有机合成的催化剂等.工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是C)为原料制备无水AlCl3的工艺(碳氯化法)流程如下:

(1)氯化炉中Al2O3、Cl2和C反应的化学方程式为______.
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为______.
(3)升华器中主要含有AlCl3和FeCl3,需加入一定量Al,其目的是______.
(4)为测定制得的无水AlCl3产品(含少量FeCl3杂质)的纯度,称取16.25g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32g.
①此过程涉及反应的离子方程式为______、______.
②AlCl3产品的纯度为______.
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3?6H2O在氯化氢的气流中加热脱去结晶水而制得无水AlCl3,其原因是______.
解:(1)根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl3,说明氯化炉的产物中含有A1C13,冷凝器尾气含有CO,所以Al2O3、C12和C反应,生成A1C13和CO,反应方程式为A12O3+3C12+3C 2A1C13+3CO,故答案为:A12O3+3C12+3C
2A1C13+3CO,故答案为:A12O3+3C12+3C 2A1C13+3CO;
2A1C13+3CO;
(2)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-.反应离子方程式为SO32-+C12+H2O═SO42-+2C1-+2H+,故答案为:SO32-+C12+H2O═SO42-+2C1-+2H+;
(3)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除FeCl3去.所以加入少量Al目的是除去FeCl3,故答案为:除去FeCl3;
(4)①除杂过程中铁离子与氢氧根离子结合成氢氧化铁沉淀,铝离子与氢氧根离子结合成偏铝酸根和水,离子方程式为:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,故答案为:Fe3++3OH-=Fe(OH)3↓;Al3++4OH-=AlO2-+2H2O;
②根据铁原子守恒,令含有杂质FeCl3质量为m,则
Fe2O3~~~~~2FeCl3
160 325
0.32g m
 =
=
解得,m=0.65g,
所以AlCl3产品的纯度为 ×100%=96%,
×100%=96%,
故答案为:96%;
(5)将AlCl3?6H2O脱水制备无水氯化铝可在HCl气流中加热脱结晶水,Al3++3 H2O?Al(OH)3+3H+,故答案为:Al3++3 H2O?Al(OH)3+3H+,抑制AlCl3水解.
分析:(1)根据工艺流程可知升华器中含有AlCl3等,所以Al2O3、C12和C反应会生成A1C13,由冷凝器尾气可知还会生成CO;
(2)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-;
(3)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除去FeCl3;
(4)制备无水AlCl3含有杂质FeCl3,残留固体质量为0.32g为Fe2O3,根据铁原子守恒计算FeCl3质量,进而计算出AlCl3的质量,再根据产品的纯度定义计算;
(5)将AlCl3?6H2O脱水制备无水氯化铝可在HCl气流中加热脱结晶水.
点评:本题考查化学方程式离子方程式的书写、物质的分离和提纯、纯度等,题目难度适中,注意将AlCl3?6H2O脱水制备无水氯化铝可在HCl气流中加热脱结晶水.
 2A1C13+3CO,故答案为:A12O3+3C12+3C
2A1C13+3CO,故答案为:A12O3+3C12+3C 2A1C13+3CO;
2A1C13+3CO;(2)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-.反应离子方程式为SO32-+C12+H2O═SO42-+2C1-+2H+,故答案为:SO32-+C12+H2O═SO42-+2C1-+2H+;
(3)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除FeCl3去.所以加入少量Al目的是除去FeCl3,故答案为:除去FeCl3;
(4)①除杂过程中铁离子与氢氧根离子结合成氢氧化铁沉淀,铝离子与氢氧根离子结合成偏铝酸根和水,离子方程式为:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,故答案为:Fe3++3OH-=Fe(OH)3↓;Al3++4OH-=AlO2-+2H2O;
②根据铁原子守恒,令含有杂质FeCl3质量为m,则
Fe2O3~~~~~2FeCl3
160 325
0.32g m
 =
=
解得,m=0.65g,
所以AlCl3产品的纯度为
 ×100%=96%,
×100%=96%,故答案为:96%;
(5)将AlCl3?6H2O脱水制备无水氯化铝可在HCl气流中加热脱结晶水,Al3++3 H2O?Al(OH)3+3H+,故答案为:Al3++3 H2O?Al(OH)3+3H+,抑制AlCl3水解.
分析:(1)根据工艺流程可知升华器中含有AlCl3等,所以Al2O3、C12和C反应会生成A1C13,由冷凝器尾气可知还会生成CO;
(2)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-;
(3)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除去FeCl3;
(4)制备无水AlCl3含有杂质FeCl3,残留固体质量为0.32g为Fe2O3,根据铁原子守恒计算FeCl3质量,进而计算出AlCl3的质量,再根据产品的纯度定义计算;
(5)将AlCl3?6H2O脱水制备无水氯化铝可在HCl气流中加热脱结晶水.
点评:本题考查化学方程式离子方程式的书写、物质的分离和提纯、纯度等,题目难度适中,注意将AlCl3?6H2O脱水制备无水氯化铝可在HCl气流中加热脱结晶水.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目