题目内容
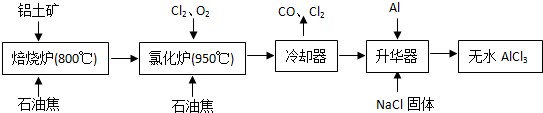
无水AlCl3易升华,可用作有机合成的催化剂等.工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下.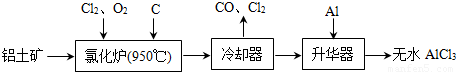
(1)氯化炉中Al2O3、C12和C反应的化学方程式为______ 2A1C13+3CO
【答案】分析:(1)根据工艺流程可知升华器中含有AlCl3等,所以Al2O3、C12和C反应会生成A1C13,由冷凝器尾气可知还会生成CO;
(2)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-;
(3)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除去FeCl3;
(4)制备无水AlCl3含有杂质FeCl3,残留固体质量为0.32g为Fe2O3,根据铁原子守恒计算FeCl3质量,进而计算出AlCl3的质量,再根据产品的纯度定义计算.
(5)氯化铝溶液发生水解,将AlCl3?6H2O脱水制备无水氯化铝可在HCl气流中加热脱结晶水.
解答:解:(1)根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl3,说明氯化炉的产物中含有A1C13,冷凝器尾气含有CO,所以Al2O3、C12和C反应,生成A1C13和CO,反应方程式为A12O3+3C12+3C 2A1C13+3CO,
2A1C13+3CO,
故答案为:A12O3+3C12+3C 2A1C13+3CO;
2A1C13+3CO;
(2)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-.反应离子方程式为SO32-+C12+H2O═SO42-+2C1-+2H+,
故答案为:SO32-+C12+H2O═SO42-+2C1-+2H+;
(3)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除FeCl3去.所以加入少量Al目的是除去FeCl3,
故答案为:除去FeCl3;
(4)①除杂过程中铁离子与氢氧根离子结合成氢氧化铁沉淀,铝离子与氢氧根离子结合成偏铝酸根和水,离子方程式为:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,
故答案为:Fe3++3OH-=Fe(OH)3↓;Al3++4OH-=AlO2-+2H2O;
②根据铁原子守恒,令含有杂质FeCl3质量为m,则:
Fe2O3~~~~~2FeCl3
160 325
0.32g m

解得,m=0.65g,
所以AlCl3产品的纯度为 ×100%=96%,
×100%=96%,
故答案为:96%;
(5)氯化铝溶液发生水解,将AlCl3?6H2O脱水制备无水氯化铝可在HCl气流中加热脱结晶水,
故答案为:在HCl气流中加热脱结晶水.
点评:本题考查学生对于工艺流程原理的理解、对操作与实验条件控制的理解等,涉及常用化学用语书写、化学计算、分离提纯等,需要学生具备扎实的基础与综合运用能力,难度中等.
(2)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-;
(3)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除去FeCl3;
(4)制备无水AlCl3含有杂质FeCl3,残留固体质量为0.32g为Fe2O3,根据铁原子守恒计算FeCl3质量,进而计算出AlCl3的质量,再根据产品的纯度定义计算.
(5)氯化铝溶液发生水解,将AlCl3?6H2O脱水制备无水氯化铝可在HCl气流中加热脱结晶水.
解答:解:(1)根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl3,说明氯化炉的产物中含有A1C13,冷凝器尾气含有CO,所以Al2O3、C12和C反应,生成A1C13和CO,反应方程式为A12O3+3C12+3C
 2A1C13+3CO,
2A1C13+3CO,故答案为:A12O3+3C12+3C
 2A1C13+3CO;
2A1C13+3CO;(2)Cl2有强氧化性,将SO32-氧化为SO42-,自身被还原为2C1-.反应离子方程式为SO32-+C12+H2O═SO42-+2C1-+2H+,
故答案为:SO32-+C12+H2O═SO42-+2C1-+2H+;
(3)升华器中主要含有AlCl3和FeCl3,FeCl3熔点、沸点较低,升华制备无水AlCl3,应除FeCl3去.所以加入少量Al目的是除去FeCl3,
故答案为:除去FeCl3;
(4)①除杂过程中铁离子与氢氧根离子结合成氢氧化铁沉淀,铝离子与氢氧根离子结合成偏铝酸根和水,离子方程式为:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,
故答案为:Fe3++3OH-=Fe(OH)3↓;Al3++4OH-=AlO2-+2H2O;
②根据铁原子守恒,令含有杂质FeCl3质量为m,则:
Fe2O3~~~~~2FeCl3
160 325
0.32g m

解得,m=0.65g,
所以AlCl3产品的纯度为
 ×100%=96%,
×100%=96%,故答案为:96%;
(5)氯化铝溶液发生水解,将AlCl3?6H2O脱水制备无水氯化铝可在HCl气流中加热脱结晶水,
故答案为:在HCl气流中加热脱结晶水.
点评:本题考查学生对于工艺流程原理的理解、对操作与实验条件控制的理解等,涉及常用化学用语书写、化学计算、分离提纯等,需要学生具备扎实的基础与综合运用能力,难度中等.

练习册系列答案
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目