题目内容
下列数量的各物质的微粒中含原子数最多的是( )
| A、12g 12C |
| B、1mol HCl |
| C、0.5mol CH4 |
| D、3.01×1023个碘分子 |
考点:物质的量的相关计算
专题:
分析:A.根据n=
=
计算;
B.根据氯化氢的分子组成分析计算;
C.1个甲烷分子中含有1个碳原子和4个氢原子;
D.根据n=
计算结合碘分子组成分析;
| m |
| M |
| N |
| NA |
B.根据氯化氢的分子组成分析计算;
C.1个甲烷分子中含有1个碳原子和4个氢原子;
D.根据n=
| N |
| NA |
解答:
解:A.12g C-12含有原子物质的量=
=1mol;
B.1molHCl中含有原子物质的量=1mol×2=2mol;
C.0.5mol CH4含有原子物质的量=0.5mol×5=2.5mol,
D.3.01×1023个碘分子,n=
=
=0.5mol,0.5molI2含有原子物质的量=0.5mol×2=1mol,
故0.5mol CH4含有原子最多,
故选C.
| 12g |
| 12g/mol |
B.1molHCl中含有原子物质的量=1mol×2=2mol;
C.0.5mol CH4含有原子物质的量=0.5mol×5=2.5mol,
D.3.01×1023个碘分子,n=
| N |
| NA |
| 3.01×1023 |
| 6.02×1023 |
故0.5mol CH4含有原子最多,
故选C.
点评:本题考查微粒数目的计算,比较基础,注意对公式的理解与灵活应用,题目难度不大.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、1molO的质量是16g/mol |
| B、2g H2的物质的量是 1 |
| C、CO2的相对分子质量为44,1 molCO2的质量为44 g/mol |
| D、NaCl的摩尔质量是58.5g/mol |
发现了电子,并提出了“葡萄干面包式”的原子模型的科学家是( )
| A、玻尔 | B、道尔顿 |
| C、汤姆生 | D、卢瑟福 |
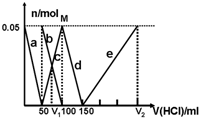 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol?L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol?L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )| A、M点时生成的CO2为0 mol |
| B、V1:V2=1:4 |
| C、原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| D、a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3↓ |

