题目内容
3.下列说法正确的是( )| A. | 硫粉在过量的纯氧中燃烧可以生成三氧化硫 | |
| B. | 用饱和碳酸钠溶液除去二氧化碳中的二氧化硫 | |
| C. | 等质量的NaHCO3和Na2CO3与足量稀盐酸反应产生CO2的量:Na2CO3<NaHCO3 | |
| D. | 过量的铁在氯气中燃烧生成FeCl2 |
分析 A、反应生成二氧化硫;
B、二氧化碳也被碳酸钠溶液吸收,生成碳酸氢钠;
C、利用n=$\frac{m}{M}$,可计算物质的量,因酸足量,利用Na2CO3~CO2,NaHCO3~CO2来分析;
D、铁在氯气中燃烧生成氯化铁.
解答 解:A、硫粉在过量的纯氧中燃烧反应生成二氧化硫,不能生成三氧化硫,故A错误;
B、二氧化碳也被碳酸钠溶液吸收,生成碳酸氢钠,应将混合气体通过饱和碳酸氢钠溶液除杂,故B错误;
C、设质量都是106g,则Na2CO3和NaHCO3的物质的量分别为1mol、$\frac{106}{84}$mol,根据Na2CO3~CO2,NaHCO3~CO2,产生的CO2的物质的量分别为1mol、$\frac{106}{84}$mol,即放出CO2的质量:Na2CO3<NaHCO3,故C正确;
D、铁在氯气中燃烧生成氯化铁,而不是氯化亚铁,与铁粉的量无关,故D错误;
故选C.
点评 本题考查碳酸钠与碳酸氢钠的性质,明确发生的化学反应是解答本题的关键,并注意利与酸的反应来分析解答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.有关下列四个常用电化学装置的叙述中正确的是( )
| A. |  如图所示碱性锌锰电池中,负极电极反应为Zn-2e-═Zn2+ | |
| B. |  如图所示铅蓄电池放电过程中,硫酸浓度不断增大 | |
| C. |  如图所示电解精炼铜装置工作过程中,电解质溶液中Cu2+浓度始终不变 | |
| D. |  如图所示银锌纽扣电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag |
14.下列物质不能用加成反应得到的是( )
| A. | CH2Cl2 | B. | CH3CH2Cl | C. | CH3CH2OH | D. |  |
11.根据“金刚石?石墨+1.896kJ”,可以得出的正确结论是( )
| A. | 石墨的能量比金刚石低 | B. | 石墨和金刚石都是碳的同位素 | ||
| C. | 金刚石转化为石墨是物理变化 | D. | 金刚石比石墨更稳定 |
18.用化学方法除去下列物质中的杂质(括号内为杂质),填写所加试剂和有关离子反应方程式.
| 试剂 | 离子反应方程式 | |
| ①Mg(Al) | ||
| ②FeCl2溶液(FeCl3) | ||
| ③NaHCO3(Na2CO3) |
8.用如图所示的装置进行实验,反应一段时间后断开K,向烧杯中加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH.下列说法中不正确的是( )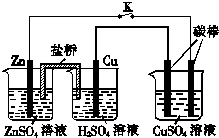

| A. | 铜棒为正极,其电极反应式为2H++2e-=H2↑ | |
| B. | 烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应中消耗锌的质量为6.5 g | |
| D. | 导线中通过电子的物质的量为0.1 mol |
15. 某种“光敏性高分子”材料在荧光屏及大规模集成电路中应用广泛.其结构可表示为:对该“光敏性高分子”叙述正确的是( )【-COO-基团与氢气不反应】
某种“光敏性高分子”材料在荧光屏及大规模集成电路中应用广泛.其结构可表示为:对该“光敏性高分子”叙述正确的是( )【-COO-基团与氢气不反应】
 某种“光敏性高分子”材料在荧光屏及大规模集成电路中应用广泛.其结构可表示为:对该“光敏性高分子”叙述正确的是( )【-COO-基团与氢气不反应】
某种“光敏性高分子”材料在荧光屏及大规模集成电路中应用广泛.其结构可表示为:对该“光敏性高分子”叙述正确的是( )【-COO-基团与氢气不反应】| A. | 化学式为(C11H11O2)n | |
| B. | 它能发生还原反应 | |
| C. | 它可以和FeCl3溶液发生显色反应 | |
| D. | 1mol该分子最多能和4molH2发生加成反应 |
12.优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极材料是聚2一乙烯吡啶(简写P2VP)和I2 的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为2Li+P2VP•nI2═P2VP•(n-1)I2+2LiI,则下列说法正确的是( )
| A. | 聚2一乙烯吡啶的复合物与有机物性质相似,因此聚2一乙烯吡啶的复合物不会导电 | |
| B. | 正极的反应为P2VP•nI2+2Li++2e-═P2VP•(n-1)I2+2LiI | |
| C. | 电池工作时,碘离子移向P2VP一极 | |
| D. | 该电池所产生的电压低,使用寿命比较短 |
13.在由水电离产生的c(H+)=1×10-14mol/L的无色溶液中,一定可以大量共存的离子组是( )
| A. | K+、Na+、HCO3-、SO42- | B. | K+、Cu2+、Cl-、NO3- | ||
| C. | NH4+、Al3+、Br-、SO42- | D. | Na+、Ba2+、Cl-、NO3- |