题目内容
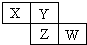 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法不正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法不正确的是( )| A、氢化物的稳定性:X>Y |
| B、W的最高价氧化物对应水化物的酸性比Z的强 |
| C、Y的非金属性比X的强 |
| D、Y与Z形成的化合物是形成酸雨的主要物质 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W均为短周期元素,由元素在周期表中的位置可知,X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是内层电子数的3倍,则Y原子最外层电子数为6,所以Y为O元素,则X为N元素,Z为S元素,W为Cl元素,
A.同周期从左到右元素的非金属性增强,非金属性越强,氢化物越稳定;
B.同周期从左到右元素的非金属性增强,非金属性越强,最高价氧化物对应水化物的酸性越强;
C.同周期从左到右元素的非金属性增强;
D.Y与Z形成的二氧化硫是形成酸雨的主要物质.
A.同周期从左到右元素的非金属性增强,非金属性越强,氢化物越稳定;
B.同周期从左到右元素的非金属性增强,非金属性越强,最高价氧化物对应水化物的酸性越强;
C.同周期从左到右元素的非金属性增强;
D.Y与Z形成的二氧化硫是形成酸雨的主要物质.
解答:
解:X、Y、Z、W均为短周期元素,由元素在周期表中的位置可知,X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是内层电子数的3倍,则Y原子最外层电子数为6,所以Y为O元素,则X为N元素,Z为S元素,W为Cl元素,
A.同周期从左到右元素的非金属性增强,则非金属性Y>X,非金属性越强,氢化物越稳定,故氢化物稳定性Y>X,故A错误;
B.同周期从左到右元素的非金属性增强,则非金属性W>Z,非金属性越强,最高价氧化物对应水化物的酸性越强,所以W的最高价氧化物对应水化物的酸性比Z的强,故B正确;
C.同周期从左到右元素的非金属性增强,则非金属性Y>X,故C正确;
D.Y与Z形成的二氧化硫是形成酸雨的主要物质,故D正确,
故选A.
A.同周期从左到右元素的非金属性增强,则非金属性Y>X,非金属性越强,氢化物越稳定,故氢化物稳定性Y>X,故A错误;
B.同周期从左到右元素的非金属性增强,则非金属性W>Z,非金属性越强,最高价氧化物对应水化物的酸性越强,所以W的最高价氧化物对应水化物的酸性比Z的强,故B正确;
C.同周期从左到右元素的非金属性增强,则非金属性Y>X,故C正确;
D.Y与Z形成的二氧化硫是形成酸雨的主要物质,故D正确,
故选A.
点评:本题考查位置结构性质关系应用,侧重对元素周期律的考查,Y是解答本题的突破口,明确短周期及元素在周期表中的位置来推断,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在2molNa2SO4中,含有Na+的数目是( )
| A、1.204×1024 |
| B、1.204×1023 |
| C、2.408×1024 |
| D、2.408×1023 |
向下列液体中投入金属钠,没有气体产生的是( )
| A、H2O |
| B、C6H6 |
| C、CH3CH2OH |
| D、CH3COOH |
下列实验设计和结论正确的是( )
| A、某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 |
| B、向0.1mol?L-1的FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有漂白性 |
| C、将碘水倒入分液漏斗中,加入适量乙醇,振荡后静置,可降碘萃取到乙醇中 |
| D、向锌粒与稀H2SO4的反应溶液中加入CuSO4,产生气泡的速度加快,说明CuSO4对此反应有催化作用 |
 NaCl是一种化工原料,可以制备一系列物质(如图所示).下列说法正确的是( )
NaCl是一种化工原料,可以制备一系列物质(如图所示).下列说法正确的是( )| A、常温下干燥Cl2能用钢瓶贮运,所以Cl2与铁不反应 |
| B、25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| C、源石灰乳与Cl2的反应中Cl2既是氧化剂,又是还原剂 |
| D、图中所示转化反应都是氧化还原反应 |