题目内容
已知反应①Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ?mol-1,平衡常数为K;
反应②CO(g)+
O2(g)═CO2(g)△H=b kJ?mol-1;
反应③Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=c kJ?mol-1.
测得在不同温度下,K值如下:
(1)若500℃时进行反应①,CO2的起始浓度为2mol?L-1,CO的平衡浓度为 .
(2)反应①为 (选填“吸热”或“放热”)反应.
(3)700℃时反应①达到平衡,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填序号).
A.缩小反应器体积 B.CO2 C.升高温度到900℃
D.使用合适的催化剂 E.增加Fe的量
(4)如图所示,图象符合反应①的是 (填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2).

(5)由反应①和②可求得,反应2Fe(s)+O2(g)═2FeO(s)的△H= .
(6)请运用盖斯定律写出Fe固体被O2氧化得到Fe2O3固体的热化学方程式 .
反应②CO(g)+
| 1 |
| 2 |
反应③Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=c kJ?mol-1.
测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.4 |
(2)反应①为
(3)700℃时反应①达到平衡,要使该平衡向右移动,其他条件不变时,可以采取的措施有
A.缩小反应器体积 B.CO2 C.升高温度到900℃
D.使用合适的催化剂 E.增加Fe的量
(4)如图所示,图象符合反应①的是

(5)由反应①和②可求得,反应2Fe(s)+O2(g)═2FeO(s)的△H=
(6)请运用盖斯定律写出Fe固体被O2氧化得到Fe2O3固体的热化学方程式
考点:化学平衡的计算,化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:(1)令平衡时CO的浓度为amol/L,表示出平衡时二氧化碳的浓度,利用平衡常数列方程计算;
(2)由表中数据可知,升高温度,平衡常数增大,反应向正反应方向移动,据此判断;
(3)根据平衡移动原理方向解答;
(4)A、由图可知,升高温度,平衡向正反应移动,故图象表示正反应吸热反应,结合反应①的热效应判断;
B、由图可知,最高点到达平衡,温度升高,混合物中CO的含量降低,平衡向逆反应进行,故图象表示正反应为放热反应,结合反应①的热效应判断;
C、由图可知,温度T1先到达平衡,故温度T1>T2,温度T1到达平衡时,混合物中CO的含量降低,平衡向逆反应进行,故图象表示正反应为放热反应,结合反应①的热效应判断;
(5)根据盖斯定律,2×(①+②)可得2Fe(s)+O2(g)═2FeO(s),反应热也进行相应的运算;
(6)依据盖斯定律结合热化学方程式计算得到;
(2)由表中数据可知,升高温度,平衡常数增大,反应向正反应方向移动,据此判断;
(3)根据平衡移动原理方向解答;
(4)A、由图可知,升高温度,平衡向正反应移动,故图象表示正反应吸热反应,结合反应①的热效应判断;
B、由图可知,最高点到达平衡,温度升高,混合物中CO的含量降低,平衡向逆反应进行,故图象表示正反应为放热反应,结合反应①的热效应判断;
C、由图可知,温度T1先到达平衡,故温度T1>T2,温度T1到达平衡时,混合物中CO的含量降低,平衡向逆反应进行,故图象表示正反应为放热反应,结合反应①的热效应判断;
(5)根据盖斯定律,2×(①+②)可得2Fe(s)+O2(g)═2FeO(s),反应热也进行相应的运算;
(6)依据盖斯定律结合热化学方程式计算得到;
解答:
解:(1)令平衡时CO的浓度为amol/L,由方程式可知,二氧化碳的浓度变化量为amol/L,则平衡时二氧化碳的浓度为(2-a)mol/L,500℃时平衡常数为1,则
=1,解得a=1,
故答案为:1mol/L;
(2)由表中数据可知,升高温度,平衡常数增大,反应向正反应方向移动,则正反应为吸热反应,即a>0,
故答案为:吸热;
(3)A.反应前后气体体积不变,缩小反应器体积,压强增大,平衡不移动,故A错误;
B.通入CO2,平衡向正反应方向移动,故B正确;
C.升高温度到900℃,平衡常数增大,平衡向正反应方向移动,故C正确;
D.使用合适的催化剂,加快反应速率,平衡不移动,故D错误;
E、固体对平衡无影响,增加Fe的量对平衡无影响,故E错误;
故答案为:BC;
(4)A、由图可知,升高温度,平衡向正反应移动,故图象表示正反应吸热反应,反应①正反应是吸热反应,图象与实际相符合,故A正确;
B、由图可知,最高点到达平衡,温度升高,混合物中CO的含量降低,平衡向逆反应进行,故图象表示正反应为放热反应,反应①正反应是吸热反应,图象与实际不相符,故B错误;
C、由图可知,温度T1先到达平衡,故温度T1>T2,温度T1到达平衡时,混合物中CO的含量降低,平衡向逆反应进行,故图象表示正反应为放热反应,反应①正反应是吸热反应,图象与实际不相符,故C错误;
故答案为:A;
(5)已知:①Fe(s)+CO2(g)═FeO(s)+CO(g)△H=a kJ?mol-1,
②CO(g)+1/2O2(g)═CO2(g)△H=b kJ?mol-1
由盖斯定律,2×(①+②)得2Fe(s)+O2(g)═2FeO(s),故△H=2(a kJ?mol-1+b kJ?mol-1)=2(a+b)kJ?mol-1,
故答案为:2(a+b)kJ?mol-1;
(6)①Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ?mol-1,平衡常数为K;
②CO(g)+
O2(g)═CO2(g)△H=b kJ?mol-1;
③Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=c kJ?mol-1;
依据盖斯定律计算②×3-③得到Fe固体被O2氧化得到Fe2O3固体的热化学方程式:2Fe(s)+
O2(g)=Fe2O3(s)△H=(3b-c)KJ/mol;
故答案为:2Fe(s)+
O2(g)=Fe2O3(s)△H=(3b-c)KJ/mol;
| a |
| 2-a |
故答案为:1mol/L;
(2)由表中数据可知,升高温度,平衡常数增大,反应向正反应方向移动,则正反应为吸热反应,即a>0,
故答案为:吸热;
(3)A.反应前后气体体积不变,缩小反应器体积,压强增大,平衡不移动,故A错误;
B.通入CO2,平衡向正反应方向移动,故B正确;
C.升高温度到900℃,平衡常数增大,平衡向正反应方向移动,故C正确;
D.使用合适的催化剂,加快反应速率,平衡不移动,故D错误;
E、固体对平衡无影响,增加Fe的量对平衡无影响,故E错误;
故答案为:BC;
(4)A、由图可知,升高温度,平衡向正反应移动,故图象表示正反应吸热反应,反应①正反应是吸热反应,图象与实际相符合,故A正确;
B、由图可知,最高点到达平衡,温度升高,混合物中CO的含量降低,平衡向逆反应进行,故图象表示正反应为放热反应,反应①正反应是吸热反应,图象与实际不相符,故B错误;
C、由图可知,温度T1先到达平衡,故温度T1>T2,温度T1到达平衡时,混合物中CO的含量降低,平衡向逆反应进行,故图象表示正反应为放热反应,反应①正反应是吸热反应,图象与实际不相符,故C错误;
故答案为:A;
(5)已知:①Fe(s)+CO2(g)═FeO(s)+CO(g)△H=a kJ?mol-1,
②CO(g)+1/2O2(g)═CO2(g)△H=b kJ?mol-1
由盖斯定律,2×(①+②)得2Fe(s)+O2(g)═2FeO(s),故△H=2(a kJ?mol-1+b kJ?mol-1)=2(a+b)kJ?mol-1,
故答案为:2(a+b)kJ?mol-1;
(6)①Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ?mol-1,平衡常数为K;
②CO(g)+
| 1 |
| 2 |
③Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=c kJ?mol-1;
依据盖斯定律计算②×3-③得到Fe固体被O2氧化得到Fe2O3固体的热化学方程式:2Fe(s)+
| 3 |
| 2 |
故答案为:2Fe(s)+
| 3 |
| 2 |
点评:本题目综合性较大,涉及反应速率计算、平衡常数、化学平衡计算、影响反应速率与化学平衡移动的因素、盖斯定律与反应热的计算等,难度中等.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
下列化学实验操作或事故处理方法不正确的是( )
| A、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
| B、浓硫酸沾到皮肤上时,可立即用大量水冲洗,然后涂上3%~5%的NaHCO3溶液 |
| C、酒精灯不慎碰倒起火时,可用湿抹布或沙子盖灭水扑灭,不能用水泼灭 |
| D、碱沾到皮肤上时,应立即用大量水冲洗,再涂上硼酸溶液 |
在酸性溶液中能大量共存,并且溶液为无色透明的是( )
| A、Na+、K+、Cu2+、SO42- |
| B、NH4+、Na+、NO3-、Cl- |
| C、K+、Ca2+、HCO3-、Cl- |
| D、Mg2+、Na+、Cl-、OH- |
 如图所示表示的是电解饱和食盐水的装置,阴极材料是铁棒,阳极材料是碳棒,饱和食盐水中含有少量酚酞.
如图所示表示的是电解饱和食盐水的装置,阴极材料是铁棒,阳极材料是碳棒,饱和食盐水中含有少量酚酞.

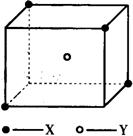 某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析: