题目内容
12.实验室里需用500mL 0.1 mol/L的硫酸铜溶液,现选取500 mL容量瓶进行配制,有关以下操作正确的是( )| A. | 称取8.0 g硫酸铜固体,加入500 mL水 | |
| B. | 配制好的硫酸铜溶液应转移到细口试剂瓶中,并贴上标签 | |
| C. | 滴加蒸馏水不慎超过刻度线,立即用胶头滴管将多余的液体吸走 | |
| D. | 定容摇匀后,发现配制溶液液面低于刻度线,应用胶头滴管滴加蒸馏水至刻度线 |
分析 A.物质的量浓度中体积为溶液的体积不是溶剂的体积;
B.液体用细口瓶盛放,并在试剂瓶贴标签;
C.滴加蒸馏水不慎超过刻度线,立即用胶头滴管将多余的液体,导致溶质的物质的量偏小;
D.定容摇匀后,发现配制溶液液面低于刻度线,应用胶头滴管滴加蒸馏水至刻度线,导致溶液体积偏大.
解答 解:A.8.0 g硫酸铜固体物质的量为$\frac{8.0g}{160g/mol}$=0.5mol,加入500 mL水,溶液体积大于500mL,溶液浓度小于0.1 mol/L,故A错误;
B.液体用细口瓶盛放,并在试剂瓶贴标签,故B正确;
C.滴加蒸馏水不慎超过刻度线,立即用胶头滴管将多余的液体,导致溶质的物质的量偏小,依据C=$\frac{n}{V}$,溶液浓度偏低,故C错误;
D.定容摇匀后,发现配制溶液液面低于刻度线,应用胶头滴管滴加蒸馏水至刻度线,导致溶液体积偏大,依据C=$\frac{n}{V}$,溶液浓度偏小,故D错误;
故选:B.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理是解题关键,注意依据C=$\frac{n}{V}$分析误差的方法,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列说法中,正确的是(NA表示阿伏加德罗常数)( )
| A. | 18g水在标准状况下的体积约为22.4L | |
| B. | 在标准状况下,22.4L氮气中含有NA个氮原子 | |
| C. | 17gNH3中含有的原子总数目为4NA | |
| D. | 80gNaOH溶解在1L水中,得到溶液的物质的量浓度为2mol/L |
20.下列说法中不正确的是( )
| A. | 标准状况下,22.4L氦气含有所含的原子数约为6.02×1023 | |
| B. | 标准状况下,aL的二氧化碳和氮气的混合物含有的分子数约为$\frac{a}{22.4}$×6.02×1023 | |
| C. | 22 g二氧化碳与标准状况下11.2 L 氯化氢气体含有的分子数相同 | |
| D. | 标准状况下,2.24L CCl4中含有的原子数约为0.5×6.02×1023 |
7.在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为(2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$O2↑+2H2O)( )
| A. | 1:1:1 | B. | 2:2:1 | C. | 2:3:1 | D. | 4:3:2 |
17.常温下,有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的盐酸;③pH=11的氨水;④pH=11的NaOH溶液.下列说法正确的是( )
| A. | ①和②混合溶液中:c(H+)=3.0mol•L-1 | |
| B. | ①和④混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | ②和③混合溶液中:c(Cl-)>c(NH4+) | |
| D. | 四种溶液稀释100倍,溶液的pH:③>④>②>① |
4.下列对某些离子的检验及结论一定正确的是( )
| A. | 先加入BaCl2溶液,产生白色沉淀,再加入HNO3溶液,白色沉淀不溶解,则溶液中一定含有大量的SO42- | |
| B. | 用洁净的铂丝蘸取待测液,置于酒精灯火焰上灼烧,观察到火焰呈黄色,则表明待测液中一定含有Na+而不含K+ | |
| C. | 加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO32- | |
| D. | 加入氯化钠溶液,有白色沉淀产生,再加入稀硝酸沉淀不消失,一定有Ag+ |
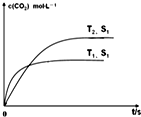 汽车尾气净化的主要原理为:2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0
汽车尾气净化的主要原理为:2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0
 +
+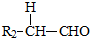 $→_{△}^{稀NaOH}$
$→_{△}^{稀NaOH}$ (R,R’为烃基或氢)
(R,R’为烃基或氢)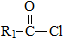 +R2OH$\stackrel{一定条件}{→}$
+R2OH$\stackrel{一定条件}{→}$ +HCl (R,R’为烃基)
+HCl (R,R’为烃基) .
.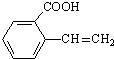 、
、 、
、 、
、 (其中之一).
(其中之一). .
.