题目内容
4.科研、生产中常涉及铁及其化合物.(1)实验室配制FeSO4溶液时,常向溶液中加入的物质有稀硫酸、铁粉.
(2)高铁酸盐在能源、环保等方面有着广泛的用途,高铁酸钾(K2FeO4)是一种理想的水处理剂,处理水时所起的作用是杀菌剂和吸附剂.
(3)高铁电池是一种新型可充电、长时间保持稳定放电电压的电池.该电池总反应式为3Zn(OH)2+2Fe(OH)3+4KOH$?_{放电}^{充电}$3Zn+2K2FeO4+8H2O,该电池放电时的负极反应为Zn-2e-+2OH-=Zn(OH)2,充电时阳极附近溶液的pH变小(填“变大”、“不变”或“变小”).
(4)高炉炼铁过程中发生下列反应:
①Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-24.8kj•mol-1
②3Fe2O3(s)+CO(g)?2Fe3O4(s)+CO2(g)△H=-47.2kj•mol-1
③Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)△H=+641.4kj•mol-1
请你写出用CO还原FeO固体制得Fe和CO2气体的热化学方程式CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol.
(5)已知:Ksp[FeS]=6.5×10-18,Ksp[CuS]=1.3-36.向浓度均为0.1mol•L-1的FeSO4 和CuSO4的混合溶液中滴加Na2S溶液,请写出首先生成沉淀的离子方程式S2-+Cu2+=CuS↓,当加入Na2S溶液至出现两种沉淀,则c(Fe2+):c(Cu2+)=5×1018.
分析 (1)FeSO4具有还原性,易水解;
(2)K2FeO4具有强氧化性,可用于杀菌消毒,可生成Fe(OH)3,具有吸附性;
(3)放电时Zn为负极,电极方程式为Zn-2e-+2OH-=Zn(OH)2,K2FeO4在正极上发生还原反应,电极方程式为FeO42-+4H2O+3e-═Fe(OH)3+5OH-;充电时电池的正极与电源的正极相连为阳极,阳极发生氧化反应,充电时的反应为放电的逆反应;
(4)利用盖斯定律将①×3-②-③×2可得;
(5)由于Ksp(FeS)>Ksp(CuS),先生成CuS沉淀,当加入Na2S溶液至出现两种沉淀,根据Ksp[FeS]计算c(S2-),再根据Ksp[CuS]计算c(Cu2+).
解答 解:(1)FeSO4具有还原性,易水解,为防止氧化,可加入铁粉,为防止水解,可加入适量硫酸,故答案为:稀硫酸、铁粉;
(2)K2FeO4具有强氧化性,可用于杀菌消毒,可生成Fe(OH)3,具有吸附性,可用于净水,故答案为:杀菌剂和吸附剂;
(3)Zn为负极,电极方程式为Zn-2e-+2OH-=Zn(OH)2,充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O,pH变小,
故答案为:Zn-2e-+2OH-=Zn(OH)2;变小;
(4)已知:①Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-24.8kj•mol-1
②3Fe2O3(s)+CO(g)?2Fe3O4(s)+CO2(g)△H=-47.2kj•mol-1
③Fe3O4(s)+CO(g)?3FeO(s)+CO2(g)△H=+641.4kj•mol-1,
①×3-②-③×2得 6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(+640.5kJ/mol)×2=-1308.0kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol,
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol;
(5)由于Ksp(FeS)>Ksp(CuS),所以在相同条件下CuS的溶解度更小,沉淀会向着生成CuS的方向进行,反应的离子方程式为S2-+Cu2+=CuS↓,
当加入Na2S溶液至出现两种沉淀,此时c(S2-)=$\frac{6.5×1{0}^{-18}}{0.1}$mol/L=6.5×10-17mol/L,c(Cu2+)=$\frac{1.3×1{0}^{-36}}{6.5×1{0}^{-17}}$mol/L=2×10-20mol/L,
则c(Fe2+):c(Cu2+)=0.1:2×10-20=5×1018,
故答案为:S2-+Cu2+=CuS↓;5×1018.
点评 本题考查较为综合,涉及原电池、热化学方程式、难溶电解质的溶解平衡等问题,为高考常见题型,侧重于学生的分析能力的考查,注意把握答题思路,难度中等.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | 少用煤作燃料 | B. | 把工厂烟囱造高 | ||
| C. | 燃烧脱硫煤 | D. | 在已酸化的土壤中加石灰 | ||
| E. | 开发新能源 |
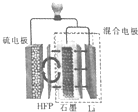 最近加拿大滑铁卢大学的科学家在锂硫(Li-S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li=6Li2S,下列说法正确的是( )
最近加拿大滑铁卢大学的科学家在锂硫(Li-S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li=6Li2S,下列说法正确的是( )| A. | 放电时,Li+向负极移动 | |
| B. | 充电时,阳极质量减少,阴极质量增加 | |
| C. | 放电时,正极的电极反应式为S62-+10e-=6S2- | |
| D. | 可用LiCl水溶液代替HFP隔膜 |
| A. | 利用一束强光照射明矾溶液,产生光亮的“通路”,说明明矾一定发生了水解 | |
| B. | 与Al反应放出H2的溶液中Mg2-、Ca2-、HCO3-、NO3-有可能大量共存 | |
| C. | Ca(ClO)2溶液中通入过量SO2的离子方程式:ClO-+SO2+H2O=HClO+HSO3- | |
| D. | 等体积、等物质的量浓度的NaX的弱酸HX混合后的溶液中c(Na+)>c(HX)>c(H+)>c(OH-) |
| A. | Si、P、S元素的最高正价依次降低 | |
| B. | Li、Na、K的原子半径依次增大 | |
| C. | C、O、N的原子半径依次减小 | |
| D. | Na、Mg、Al原子的最外层电子数依次减少 |
| A. | 用食醋除去热水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| B. | Al溶于NaOH溶液:Al+2OH-═AlO2-+H2↑ | |
| C. | Cl2溶于水:Cl2+H2O═H++Cl-+HClO | |
| D. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
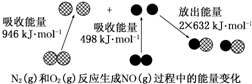
下列说法正确的是( )
| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和O2(g)混合能直接生成NO(g) | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
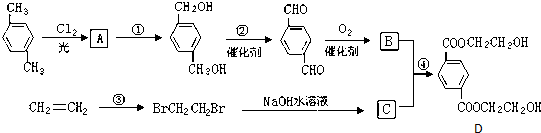
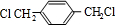 、
、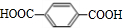 、HOCH2CH2OH.
、HOCH2CH2OH.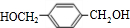 +2NaCl;水解(取代)反应.
+2NaCl;水解(取代)反应.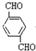 与银氨溶液反应的化学方程式OHCC6H4CHO+4Ag(NH3)2OH$\stackrel{水浴加热}{→}$NH4OOCC6H4COONH4+4Ag↓+6NH3↑+2H2O.
与银氨溶液反应的化学方程式OHCC6H4CHO+4Ag(NH3)2OH$\stackrel{水浴加热}{→}$NH4OOCC6H4COONH4+4Ag↓+6NH3↑+2H2O.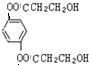 )与足量NaOH溶液反应的化学方程式:
)与足量NaOH溶液反应的化学方程式: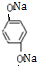 +2HOCH2CHCOONa.
+2HOCH2CHCOONa.