题目内容
8.在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得达到平衡时的有关数据如下[已知X(g)+3Y(g)?2Z(g)△H=-Q kJ•mol-1]:| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol X、3mol Y | 2mol Z | 4mol Z |
| Z的浓度 (mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | 2c1>c3 | B. | a+b=Q | C. | 2p2<p3 | D. | α1+α3>1 |
分析 甲容器反应物投入1mol X、3mol Y,乙容器反应物投入量2mol Z,恒温且乙容器容积和甲容器相同,则甲容器与乙容器是等效平衡;甲容器反应物投入1mol X、3mol Y,丙容器反应物投入量4molZ,采用极限转化法转化为反应物为2molX、6molY,是甲中的二倍,如果恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡;所以丙所到达的平衡,可以看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所到达的平衡,所以丙与甲、乙相比,增大了压强,平衡向着正向移动,小容器体积,增大了压强,平衡向着正向移动,所以丙中X、Y转化率大于甲和乙的,据此进行解答.
解答 解:甲容器反应物投入1mol X、3mol Y,乙容器反应物投入量2mol Z,恒温且乙容器容积和甲容器相同,则甲容器与乙容器是等效平衡;甲容器反应物投入1mol X、3mol Y,丙容器反应物投入量4molZ,采用极限转化法转化为反应物为2molX、6molY,是甲中的二倍,如果恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡;所以丙所到达的平衡,可以看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所到达的平衡,所以丙与甲、乙相比,增大了压强,平衡向着正向移动,小容器体积,增大了压强,平衡向着正向移动,所以丙中X、Y转化率大于甲和乙的,
A、丙容器反应物投入量4molZ,采用极限转化法转化为反应物为2molX、6molY,是甲中的二倍,若平衡不移动,c3=2c1;丙相当于增大压强,平衡向着正向移动,所以丙中氨气的浓度大于乙中氨气浓度的二倍,即c3>2c1,故A错误;
B、甲投入1molX、3molY,乙中投入2molZ,则甲与乙是完全等效的,根据盖斯定律可知,甲与乙的反应的能量变化之和为QkJ,故a+b=Q,故B正确;
C、丙容器反应物投入量4molZ,是乙的二倍,若平衡不移动,丙中压强为乙的二倍;由于丙中相当于增大压强,平衡向着向着正向移动,所以丙中压强减小,小于乙的2倍,即2p2>p3,故C错误;
D、丙容器反应物投入量4molZ,是乙的二倍,若平衡不移动,转化率α1+α3=1;由于丙中相当于增大压强,平衡向着向着正向移动,氨气的转化率减小,所以转化率α1+α3<1,故D错误;
故选B.
点评 本题考查化学平衡影响因素、等效平衡、化学平衡的计算,题目难度较大,解答的关键是构建平衡建立的等效途径,试题侧重对学生灵活运用基础知识解决实际问题的能力的培养.

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案| A. | 75% | B. | 25% | C. | 79.1% | D. | 78.1% |
| A. |  读数 | B. |  稀释 | C. |  称量 | D. |  溶解 |
 向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )
向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )| A. | 线段Ⅱ表示Br-的变化情况 | B. | 原溶液中n(FeI2):n(FeBr2)=3:1 | ||
| C. | 根据图象无法计算a的值 | D. | 线段Ⅳ表示IO${\;}_{3}^{-}$的变化情况 |

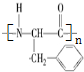 (写结构简式);
(写结构简式); ;
;