题目内容
6.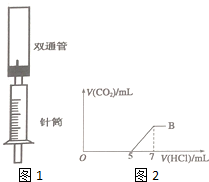 为探究Na2CO3与盐酸的反应原理,设计了如图1实验装置.
为探究Na2CO3与盐酸的反应原理,设计了如图1实验装置.Ⅰ.步骤如下:
(1)在双通管中装12mL0.5mol/L的Na2CO3溶液,在针筒中装4mL3mol/L的盐酸.
(2)从底部向双通管中推入2mL的盐酸.几乎没有气泡产生,原因是:CO32-+H+=HCO3-(用离子方程式解释).
(3)将盐酸全部注入,产生大量气泡.
Ⅱ.此装置相对于往Na2CO3溶液中滴加盐酸,优点在于:便于判断消耗盐酸的体积及反应的程度.
Ⅲ.利用此装置往含往Na2CO3和另一种含钠的化合物A的混合液中注入稀盐酸,注入盐酸的体积与产生气体的体积关系如图2,则A的化学式为NaOH,该混合液中Na2CO3和A的物质的量之比为2:3.
分析 I.n(Na2CO3)=0.012L×0.5mol/L=0.006mol,发生CO32-+H+=HCO3-,需要V(HCl)=$\frac{0.006mol}{3mol/L}$=0.002L=2mL;
Ⅱ.此装置相对于往Na2CO3溶液中滴加盐酸,便于判断消耗盐酸的体积及反应的程度;
Ⅲ.由图可知,发生HCO3-+H+=CO2↑+H2O时消耗盐酸为7-5=2mL,则由可知CO32-+H+=HCO3-可知含Na2CO3共消耗盐酸4mL,则前3mL发生NaOH+HCl═H2O+NaCl,以此计算.
解答 解:I.n(Na2CO3)=0.012L×0.5mol/L=0.006mol,发生CO32-+H+=HCO3-,需要V(HCl)=$\frac{0.006mol}{3mol/L}$=0.002L=2mL,则从底部向双通管中推入2mL的盐酸.几乎没有气泡产生,原因是CO32-+H+=HCO3-,
故答案为:2;CO32-+H+=HCO3-;
Ⅱ.此装置相对于往Na2CO3溶液中滴加盐酸,针筒上有刻度,便于判断消耗盐酸的体积及反应的程度,
故答案为:便于判断消耗盐酸的体积及反应的程度;
Ⅲ.由图可知,发生HCO3-+H+=CO2↑+H2O时消耗盐酸为7-5=2mL,则由可知CO32-+H+=HCO3-可知含Na2CO3共消耗盐酸4mL,则前3mL发生NaOH+HCl═H2O+NaCl,则A为NaOH,该混合液中Na2CO3和A的物质的量之比为(0.004L×3mol/L×$\frac{1}{2}$):(0.003L×3mol/L)=2:3,
故答案为:NaOH;2:3.
点评 本题考查性质实验,为高频考点,把握装置的作用、发生的反应与图象关系为解答的关键,侧重分析与实验、计算能力的考查,题目难度不大.

| A. | 可能是酸性溶液 | B. | 可能是碱性溶液 | C. | 可能是中性溶液 | D. | 不能判断 |
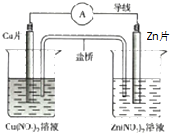
| A. | 盐桥中阴离子向正极移动 | |
| B. | 正极的电极反应是:Zn2++2e-═Zn | |
| C. | Zn片上发生氧化反应 | |
| D. | 用该电池电解水,析出3.2gCu时生成1.12LO2(标况下) |
| A. | OH-的物质的量相同 | B. | H+ 物质的量相同 | ||
| C. | OH-的物质的量浓度不同 | D. | H+的物质的量浓度相同 |
| A. | O2与O3 | B. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C | ||
| C. | CH2Cl2与CHCl3 | D. | CH3-CH2-CH2-CH3与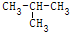 |
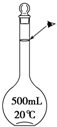 实验室配制500mL 0.1mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.1mol•L-1的NaCl溶液,有如下操作步骤: 图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,回答问题:
图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,回答问题: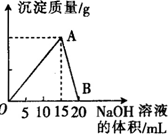 向20mL 某浓度的AlCl3溶液中滴入2mol•L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20mL 某浓度的AlCl3溶液中滴入2mol•L-1的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示: