题目内容
5.已知反应:①101kPa时,C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-110.5kJ•mol-1
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ•mol-1
下列结论正确的是( )
| A. | 浓硫酸与稀NaOH溶液反应的中和热为57.3 kJ•mol-1 | |
| B. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量为57.3 kJ | |
| C. | 若碳的燃烧热用△H3来表示,则△H3<△H1 | |
| D. | 若碳的燃烧热用△H3来表示,则△H3>△H1 |
分析 A、浓硫酸溶解放热;
B、醋酸是弱酸存在电离平衡,电离过程是吸热过程分析;
C、依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物反应放出的热量分析判断;
D、依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物反应放出的热量分析判断.
解答 解:A、浓硫酸溶解放热,所以浓硫酸与稀NaOH溶液反应放出的热量大于57.3 kJ/mol,故A错误;
B、醋酸是弱电解质,电离需吸收热量,稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3 kJ,故B错误;
C、燃烧热是1mol可燃物完全燃烧生成稳定氧化物反应放出的热量,所以C燃烧应该生成二氧化碳,则放出热量大于110.5kJ,则△H3<△H1,故C正确;
D、燃烧热是1mol可燃物完全燃烧生成稳定氧化物反应放出的热量,所以C燃烧应该生成二氧化碳,则放出热量大于110.5kJ,则△H3<△H1,故D错误;
故选C.
点评 本题考查学生对于反应热、中和热的理解及有关计算等,难度不大,注意稀的强酸、强碱的中和热为△H=-57.3kJ/mol.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
16.下列有关分液漏斗说法正确的是( )
| A. | 使用分液漏斗前不用检查活塞处是否漏水 | |
| B. | 放气时,直接打开上口玻璃塞 | |
| C. | 分液操作时,下层液体从下端放出,上层液体从上口倒出 | |
| D. | 应选用球形分液漏斗进行分液 |
13.下列反应中,调节反应物用量或浓度不会改变反应产物的是( )
①KHCO3溶液与石灰水反应,②Na2SO3溶液与稀盐酸反应,
③Si与烧碱溶液反应,④Fe与稀硝酸反应,
⑤金属钠在氧气中燃烧,⑥二氧化硫通入石灰水,
⑦铁在硫蒸气中燃烧.
①KHCO3溶液与石灰水反应,②Na2SO3溶液与稀盐酸反应,
③Si与烧碱溶液反应,④Fe与稀硝酸反应,
⑤金属钠在氧气中燃烧,⑥二氧化硫通入石灰水,
⑦铁在硫蒸气中燃烧.
| A. | ①④⑦ | B. | ①②④⑤ | C. | ③⑦ | D. | ③⑤⑦ |
20.现有失去标签的氯化钙、硝酸银、盐酸、碳酸钠四种无色溶液,为了明确四种溶液各自是什么,将它们随意编号A、B、C、D后,产生的现象记录于下表.
(1)A、D溶液中溶质的化学式:A:CaCl2;D:Na2CO3.
(2)写出上述实验中的有关化学方程式:
③HCl+AgNO3═AgCl↓+HNO3;
④CaCl2+Na2CO3═2NaCl+CaCO3↓.
| 实 验 顺 序 | 实 验 内 容 | 实 验 现 象 |
| ① | A+B | 没有现象 |
| ② | B+D | 有气体放出 |
| ③ | B+C | 有沉淀生成 |
| ④ | A+D | 有沉淀生成 |
(2)写出上述实验中的有关化学方程式:
③HCl+AgNO3═AgCl↓+HNO3;
④CaCl2+Na2CO3═2NaCl+CaCO3↓.
10.下列有关实验的装置、试剂选用或操作正确的是( )
| A.配制0.10mol•L-1溶液 | B.除去CO中的CO2 | C.苯萃取碘水中I2,分出水层后的操作 | D.记录滴定终点读数为12.20mL |
 | 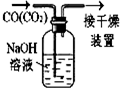 |  |  |
| A. | A | B. | B | C. | C | D. | D |
15.下列事实与胶体性质无关的是( )
| A. | 向豆浆中加入盐卤做豆腐 | |
| B. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| C. | 高压除尘 | |
| D. | 黄河入海口处容易形成三角洲 |

 ;工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,请写出电解反应方程式2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;在电解过程中阳极(填“阴”或“阳”)需要定期补充.
;工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,请写出电解反应方程式2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;在电解过程中阳极(填“阴”或“阳”)需要定期补充.