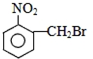
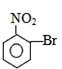
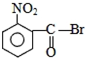
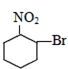
题目内容
11.在浓硝酸中放入铜片发生反应:(1)待反应停止后,若铜有剩余,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(用离子方程式表示)
(2)若将12.8g铜跟一定量的浓硝酸反应,铜耗完时,共产生气体5.6L(标况).则所消耗硝酸的物质的量是0.65 mol
(3)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2,使其充分反应,若要使水恰好充满容器,理论上需要参加反应的O2的物质的量是0.1mol.
分析 (1)酸性条件下,硝酸根离子具有强氧化性,能氧化Cu生成铜离子,自身被还原生成NO;
(2)n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,Cu生成Cu(NO3)2,同时生成氮氧化物NOx,n(NOx)=$\frac{5.6L}{22.4L/mol}$=0.25mol,根据N原子守恒得消耗n(HNO3)=2n[Cu(NO3)2]+n(NOx);
(3)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2,使其充分反应,该反应中氧气得电子和氮氧化物转化为硝酸,根据转移电子守恒知,Cu失去电子数等于氧气得到电子数.
解答 解:(1)酸性条件下,硝酸根离子具有强氧化性,能氧化Cu生成铜离子,自身被还原生成NO,离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,Cu生成Cu(NO3)2,同时生成氮氧化物NOx,n(NOx)=$\frac{5.6L}{22.4L/mol}$=0.25mol,根据N原子守恒得消耗n(HNO3)=2n[Cu(NO3)2]+n(NOx)=2×0.2mol+0.25mol=0.65mol,
故答案为:0.65;
(3)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2,使其充分反应,该反应中氧气得电子和氮氧化物转化为硝酸,根据转移电子守恒知,Cu失去电子数等于氧气得到电子数,所以消耗氧气物质的量=$\frac{0.2mol×2}{4}$=0.1mol,故答案为:0.1.
点评 本题考查氧化还原反应有关计算,侧重考查学生分析计算能力,明确反应过程中存在的转移电子守恒、原子守恒是解本题关键,难点是(3)题计算.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案| A. | 胶体区别其他分散系本质特征是分散质微粒直径在lnm~100nm之间 | |
| B. | Fe(OH)3胶体能够使水中的悬浮的固体颗粒沉降,达到净水目的 | |
| C. | 用滤纸可分离溶液和胶体 | |
| D. | 光线通过胶体时会产生丁达尔效应 |
| A. | 开发新能源,如太阳能、风能等,减少对化石能源的依赖,也减少对大气的污染 | |
| B. | 直径接近于2.5×10-6m的颗粒物(PM2.5)分散在空气中形成的混合物具有丁达尔效应 | |
| C. | 实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境 | |
| D. | 汽油发动机工作时会产生一定量的NO和CO,采用三元催化装置可以减少污染物的排放 |
| A. | 9 | B. | 12 | C. | 18 | D. | 24 |
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 1 mol•L-1AlCl3溶液 | ||
| C. | 75 mL 2 mol•L-1CaCl2溶液 | D. | 200 mL 2 mol•L-1 KCl溶液 |
| A. | 自发反应一定是熵增大,非自发反应一定是熵减小或不变 | |
| B. | Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 | |
| C. | pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)不相等 | |
| D. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
| A. | 水泥、玻璃、水晶饰物都是硅酸盐制品 | |
| B. | 高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应 | |
| C. | 光导纤维的主要成分是SiO2 | |
| D. | 自然界中硅元素的贮量丰富,并存在大量的单质硅 |