题目内容
3. 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )
CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )| A. | 若不改变温度,减小压强使乙苯转化率和反应速率都减小 | |||||||||||
| B. | 已知
| |||||||||||
| C. | A、B两点对应的平衡常数大小:KA<KB | |||||||||||
| D. | 投料比的大小顺序:M1<M2<M3 |
分析 A.若不改变温度,减小压强,平衡逆向移动,反应速率减小;
B.反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差;
C.随温度升高,乙苯转化率增大,说明升温平衡正向进行,正反应为吸热反应,A、B两点B点温度高;
D.乙苯量越多,投料比越小,乙苯转化率越小,据此分析判断M的值.
解答 解:A.若不改变温度,减小压强,平衡逆向移动,乙苯的转化率和反应速率都减小,故A正确;
B.由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,故△H=(5×412+348-3×412-612-436)kJ•mol-1=+124kJ•mol-1,故B错误;
C.图象分析可知,随温度升高,乙苯转化率增大,说明升温平衡正向进行,正反应为吸热反应,A、B两点B点温度高,平衡正向进行程度大,平衡常数B点大,KA<KB,故C正确;
D.乙苯量越多,投料比越小,乙苯转化率越小,恒压条件下,水蒸气含量越高,分压越小,平衡朝体积增大方向移动,据此分析判断M的值,M1>M2>M3,故D错误;
故选AC.
点评 本题考查了化学平衡的计算、图象分析应用,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握三段式在化学平衡的计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.在电解质溶液均为稀硫酸的情况下,不能构成原电池的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
17.下列说法正确的是( )
| A. | 常温下将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低 | |
| C. | 25℃时,用醋酸溶液滴定等浓度的NaOH溶液至pH=7,V醋酸>VNaOH | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液呈中性 |
14.下列物质按照纯净物、化合物、在水溶液中能全部电离的物质、在水溶液中部分电离的物质和非电解质顺序排列的是( )
| A. | 盐酸、天然气、硫酸、醋酸、干冰 | |
| B. | 冰水混合物、胆矾、氯化钾、碳酸、乙醇 | |
| C. | 四氯化碳、硝酸、硫酸钡、二氧化碳、氧气 | |
| D. | 白酒、空气、苛性钠、硫酸、三氧化硫 |
15.CH4是一种重要的化石燃料,在工农业生产中有着极其重要的应用.用甲烷可以消除氮氧化物的污染,其反应如下:
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g).
在130℃和180℃时,分别将0.50mol CH4和a mol NO2充入1L的密闭容器中发生反应,测得有关数据如表:
(1)130℃时,达到平衡状态时CH4的转化率为80%.当温度为180℃、反应到40min时,该反应是(填“是”或“否”)达到平衡,推断的依据是温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态.
(2)由表中数据分析可知,该反应的△H<0(填“=”、“>”或“<”),130℃和180℃平衡常数的关系:K(130℃)>K(180℃)(填“=”、“>”或“<”).
(3)如图1所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜.
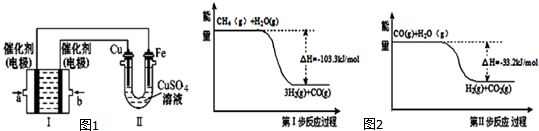
①a电极上发生反应的电极反应式是CH4+10OH--8e-=CO32-+7H2O.
②电镀结束后,装置Ⅰ中溶液的pH减小(填“增大”、“减小”或“不变”).
③若完全反应后,装置Ⅱ中Cu极质量减少12.8g,则装置Ⅰ中理论上消耗甲烷1.12L(标准状况下).
(4)用甲烷制取氢气的反应分为两步,其能量变化如图2所示:
写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5 kJ/mol.
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g).
在130℃和180℃时,分别将0.50mol CH4和a mol NO2充入1L的密闭容器中发生反应,测得有关数据如表:
| 实验编号 | 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
(2)由表中数据分析可知,该反应的△H<0(填“=”、“>”或“<”),130℃和180℃平衡常数的关系:K(130℃)>K(180℃)(填“=”、“>”或“<”).
(3)如图1所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜.

①a电极上发生反应的电极反应式是CH4+10OH--8e-=CO32-+7H2O.
②电镀结束后,装置Ⅰ中溶液的pH减小(填“增大”、“减小”或“不变”).
③若完全反应后,装置Ⅱ中Cu极质量减少12.8g,则装置Ⅰ中理论上消耗甲烷1.12L(标准状况下).
(4)用甲烷制取氢气的反应分为两步,其能量变化如图2所示:
写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5 kJ/mol.
12.900℃时,向2.0L恒容密闭容器中充入0.40molX,发生反应:X(g)?Y(g)+Z(g)△H=akJ•mol-1,经一段时间后达到平衡.反应过程中测定的部分数据见表:
下列说法正确的是( )
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(X)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(Y)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 反应在前10 min的平均速率为v(Z)=0.01mol•L-1•min-1 | |
| B. | 保持其他条件不变,降低温度,平衡时,c(X)=0.08mol•L-1,则a>0 | |
| C. | 恒压,其他条件不变,向容器中充入不参与反应的氮气作为稀释剂,X的转化率大于50.0% | |
| D. | 保持其它条件不变,再向容器中充入0.10 mol Y和0.10 mol Z,达到平衡后,该反应的平衡常数为0.2 |
13.由于易被氧化而不能长期存放在敞口容器中的是( )
| A. | 浓硫酸 | B. | 浓盐酸 | C. | 绿矾 | D. | 氢氧化钠固体 |
