题目内容
14.下列物质按照纯净物、化合物、在水溶液中能全部电离的物质、在水溶液中部分电离的物质和非电解质顺序排列的是( )| A. | 盐酸、天然气、硫酸、醋酸、干冰 | |
| B. | 冰水混合物、胆矾、氯化钾、碳酸、乙醇 | |
| C. | 四氯化碳、硝酸、硫酸钡、二氧化碳、氧气 | |
| D. | 白酒、空气、苛性钠、硫酸、三氧化硫 |
分析 纯净物是指由同种物质组成的,混合物是指由不同种物质组成的,单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物;在水溶液中能全部电离的物质为强电解质,水溶液中部分电离的化合物为弱电解质;非电解质是指在水溶液里和熔化状态下都不能够导电的化合物,据此可以分析各个选项中各种的所属类别.
解答 解:A.盐酸是氯化氢的水溶液,属于混合物,故A错误;
B.冰水混合物、胆矾、氯化钾、碳酸、乙醇依次是纯净物、化合物、强电解质、弱电解质和非电解质,故B正确;
C.氧气为单质,单质既不是电解质也不是非电解质,故C错误;
D.空气为混合物,不是化合物;硫酸在溶液中完全电离,故D错误;
故选B.
点评 本题考查了物质的分类方法判断,题目难度不大,明确常见物质的分类依据及区别为解答关键,注意掌握混合物与化合物、电解质与非电解质、强电解质与弱电解质的概念,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
5. 以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.
以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.
某实验兴趣小组做完实验后,在读书卡片上记录如下:

(1)在卡片上,记录合理的是⑤⑥(填序号).
(2)其他条件相同情况下,产生气泡的速率比单一锌片快(填“快”或“慢”),如果将锌片换成铁片,电路中的电流方向不变(填“变”或“不变”).
(3)如果把硫酸换成硫酸铜溶液,猜测铜片(填“锌片”或“铜片”)变厚,原因是Cu2++2e-=Cu(用电极方程式表示).实验结束后称得两极质量差12.9g,假设初始时Zn片与Cu片质量相等,则反应中转移的电子的物质的量为0.2mol.
(4)有同学利用原电池原理,将A、B、C、D四种金属设计成下表中装置进行实验用以判断四种金属的活泼性强弱.
根据以上现象,判断四种金属活泼性由强到弱的顺序是D>A>B>C.
 以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.
以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如图所示.某实验兴趣小组做完实验后,在读书卡片上记录如下:

(1)在卡片上,记录合理的是⑤⑥(填序号).
(2)其他条件相同情况下,产生气泡的速率比单一锌片快(填“快”或“慢”),如果将锌片换成铁片,电路中的电流方向不变(填“变”或“不变”).
(3)如果把硫酸换成硫酸铜溶液,猜测铜片(填“锌片”或“铜片”)变厚,原因是Cu2++2e-=Cu(用电极方程式表示).实验结束后称得两极质量差12.9g,假设初始时Zn片与Cu片质量相等,则反应中转移的电子的物质的量为0.2mol.
(4)有同学利用原电池原理,将A、B、C、D四种金属设计成下表中装置进行实验用以判断四种金属的活泼性强弱.
| 序号 | 甲 | 乙 | 丙 |
| 装置 |  |  |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
2.下列气体的制备和性质实验中,由现象得出的结论错误的是( )
| 选项 | 试剂 | 试纸或试液 | 现象 | 结论 |
| A | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
| B | 浓盐酸、浓硫酸 | pH试纸 | 变红 | HCl为酸性气体 |
| C | 浓盐酸、二氧化锰 | 淀粉-KI试液 | 先变蓝后褪色 | Cl2具有氧化性和漂白性 |
| D | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
9.某化学反应的△H=+120KJ/mol,△S=+100J/(mol•k),则该反应能自发进行的是( )
| A. | 仅在高温下 | B. | 在任何温度下都不能自发进行 | ||
| C. | 在任何温度下 | D. | 仅在低温下 |
3. 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )
CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )
CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )| A. | 若不改变温度,减小压强使乙苯转化率和反应速率都减小 | |||||||||||
| B. | 已知
| |||||||||||
| C. | A、B两点对应的平衡常数大小:KA<KB | |||||||||||
| D. | 投料比的大小顺序:M1<M2<M3 |


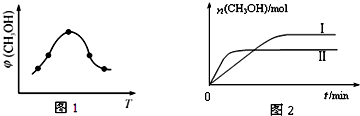 研究CO2的利用对促进低碳社会的构建具有重要意义.
研究CO2的利用对促进低碳社会的构建具有重要意义.