题目内容
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
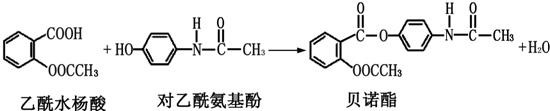
有关上述反应物和产物的叙述正确的是( )

有关上述反应物和产物的叙述正确的是( )
| A、上述反应类型为取代反应 |
| B、按碳的骨架分类,上述三种有机物均属于芳香烃 |
| C、1mol乙酰水杨酸最多能与含2mol NaOH的水溶液发生反应 |
| D、贝诺酯分子中有三种不同类型的含氧官能团 |
考点:有机物的结构和性质
专题:有机物的化学性质及推断
分析:A.根据取代反应的定义判断;
B.芳香烃属于烃,烃只含碳和氢两种元素;
C.羧基和酯基都可与NaOH反应;
D.贝诺酯分子中有-COOC-、-NH-CO-.
B.芳香烃属于烃,烃只含碳和氢两种元素;
C.羧基和酯基都可与NaOH反应;
D.贝诺酯分子中有-COOC-、-NH-CO-.
解答:
解:A.发生酯化反应,符合取代反应的特征,也为取代反应,故A正确;
B.三种有机物都含有O元素,而烃只含碳和氢两种元素,故B错误;
C.乙酰水杨酸水解可生成酚羟基、羧基,都可与氢氧化钠反应,则1mol乙酰水杨酸最多能与含3mol NaOH的水溶液发生反应,故C错误;
D.贝诺酯分子中有-COOC-、-NH-CO-,两种含氧官能团,故D错误.
故选A.
B.三种有机物都含有O元素,而烃只含碳和氢两种元素,故B错误;
C.乙酰水杨酸水解可生成酚羟基、羧基,都可与氢氧化钠反应,则1mol乙酰水杨酸最多能与含3mol NaOH的水溶液发生反应,故C错误;
D.贝诺酯分子中有-COOC-、-NH-CO-,两种含氧官能团,故D错误.
故选A.
点评:本题考查有机物的结构和性质,明确酚及酯的性质是解答本题的关键,注意选项C中的水解为解答的难点和易错点,题目难度中等.

练习册系列答案
相关题目
下列化学用语表述正确的是( )
| A、碳酸溶于水的电离方程式:H2CO3?CO32-+2H+ |
| B、标准状况下将112mL Cl2通入10 mL 1 mol?L-1 FeBr2溶液的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
C、用单线桥表示浓盐酸和KClO3反应的电子转移的数目与方向: |
D、过氧化钠的电子式为: |
下列说法中正确的是( )
| A、已知T1℃时反应C+CO2?2CO;△H>0的速率为v,若升高温度,逆反应速率降低 |
| B、在恒压容器中发生反应N2+O2?2NO,若往容器中充入He,正逆反应的速率均不变 |
| C、对任何一个化学反应,温度发生变化,化学反应速率一定发生变化 |
| D、以上说法均不合理 |
已知NaHSO4、MgS、MgSO4组成的混合物中,硫元素的质量分数为48%,则混合物中氧元素的质量分数为( )
| A、16% | B、25% |
| C、50% | D、无法确定 |
等质量下列物质,所含分子数最多的是( )
| A、CO2 |
| B、CH4 |
| C、O2 |
| D、N2 |
服药(片剂)时,应选用下列哪种物质送服( )
| A、白开水 | B、茶水 | C、白酒 | D、汽水 |
将一定浓度的盐酸倒入碳酸钙中,若作如下改变的情况,其中能使最初的化学反应速率增大的是( )
①盐酸的浓度不变,而使盐酸的用量一倍
②盐酸的浓度增大一倍,而使盐酸的用量减少到原来的一半
③盐酸的浓度和用量都不变,增加碳酸钙的量
④盐酸和碳酸钙不变,增大压强一倍
⑤加入CaCl2溶液
⑥加入CaCl2固体
⑦将CaCO3用CaCO3粉末代替.
①盐酸的浓度不变,而使盐酸的用量一倍
②盐酸的浓度增大一倍,而使盐酸的用量减少到原来的一半
③盐酸的浓度和用量都不变,增加碳酸钙的量
④盐酸和碳酸钙不变,增大压强一倍
⑤加入CaCl2溶液
⑥加入CaCl2固体
⑦将CaCO3用CaCO3粉末代替.
| A、①② | B、②⑦ |
| C、②④⑦ | D、全部正确 |
下列叙述中正确的是( )
| A、向Ba(NO3)2溶液中通入CO2无沉淀生成,可推知向Ba(NO3)2溶液中通入SO2也无淀生成 |
| B、向FeI2溶液中通入少量Cl2无Fe3+生成,可推知向FeBr2溶液中少量Cl2也无Fe3+生成 |
| C、向品红溶液中加人H2O2溶液时,品红溶液褪色,可推知向品红溶液中通人Cl2时,品红溶液也会褪色 |
| D、向CuSO4溶液中加入铁时会置换出铜,可推知向CuSO4溶液中加人钠时也会置换出铜 |
下列反应的离子方程式书写正确的是( )
| A、氯气用氢氧化钠溶液吸收:Cl2+2OH-═Cl-+ClO-+H2O | ||
| B、稀H2SO4溶液与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | ||
C、氢氧化钡溶液与CuSO4溶液反应:Ba2++S
| ||
| D、碳酸钡与稀盐酸溶液反应:CO32-+2H+═CO2↑+H2O |