题目内容
12.SO2是一种大气污染物,下列有关SO2的说法表示的方程式不合理的是( )| A. | SO2在大气中最终能生成H2SO4:2SO2+O2+2H2O=2H2SO4 | |
| B. | 少量SO2与NaOH溶液反应的离子方程式是:SO2+OH-=HSO3- | |
| C. | NaOH溶液缓慢吸收过量SO2的过程中有:SO2+SO32-+H2O=2HSO3- | |
| D. | 木炭和浓硫酸共热可生成SO2:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O |
分析 A.发生氧化还原反应生成硫酸;
B.少量SO2与NaOH溶液反应,生成亚硫酸钠和水;
C.吸收过量SO2,生成亚硫酸氢钠;
D.发生氧化还原反应生成水、二氧化碳、二氧化硫.
解答 解:A.发生氧化还原反应生成硫酸,反应为2SO2+O2+2H2O=2H2SO4,遵循电子、原子守恒,故A正确;
B.少量SO2与NaOH溶液反应,生成亚硫酸钠和水,离子反应为SO2+2OH-=SO32-+H2O,故B错误;
C.NaOH溶液缓慢吸收过量SO2发生SO2+2OH-=SO32-+H2O、SO2+SO32-+H2O=2HSO3-,故C正确;
D.发生氧化还原反应生成水、二氧化碳、二氧化硫,反应为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,遵循电子、原子守恒,故D正确;
故选B.
点评 本题考查离子方程式的书写,为高频考点,把握物质的性质、发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意与量有关的反应、氧化还原反应中电子守恒的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列各项中表达正确的是( )
| A. | 硫离子(S2-)的核外电子排布式:1s22s22p63s23p6 | |
| B. | N2的结构式::N≡N: | |
| C. | NaCl的电子式: | |
| D. | CO2的分子模型示意图: |
3.下列叙述正确的是( )
| A. | C5H11Cl有8种同分异构体 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 聚氯乙烯与乙烯性质相似,可使溴水褪色 | |
| D. | 相同条件下,熔沸点:正丁烷<异丁烷 |
20.工业上,通常采用电解法处理酸性废水中的Cr2O72-,装置示意图如图所示.下列说法正确的是( )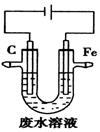

| A. | 石墨极上发生氧化反应 | |
| B. | 阳极的电极反应式为Fe-3e-=Fe3+ | |
| C. | 除去Cr2O72-的反应:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 随着电解的进行,石墨极附近电解质溶液的pH会减小 |
7.用NA表示阿伏加德罗常数的值,下列有关氯及其化合物的说法正确的是( )
| A. | 7.1gCl2所含电子数为3.4NA | |
| B. | 1molFe与足量Cl2反应,转移的电子数为2NA | |
| C. | 常温常压下,11.2LHCl含有的分子数为0.5NA | |
| D. | 1L1mol/LAlCl3溶液中Cl-的数目为NA |
17.下列有关物质的性质和用途均正确且有因果关系的是( )
| 选项 | 性质 | 用途 |
| A | Fe3+有氧化性 | 可用饱和FeCl3溶液制备Fe(OH)3胶体 |
| B | SiO2有导电性 | 可用SiO2制光导纤维 |
| C | NH3有还原性 | 可用NH3制取NO |
| D | 浓HNO3有酸性 | 可用铁制容器盛放浓HNO3 |
| A. | A | B. | B | C. | C | D. | D |
4.下列关于金属钠的说法中,不正确的是( )
| A. | 钠能从水溶液中置换出铜 | |
| B. | 钠长期置于空气中,最后变成碳酸钠 | |
| C. | 钠和氧气反应,条件不同,产物不同 | |
| D. | 钠与水反应时,钠熔成小球在水面四处游动 |
17.下列反应不属于水解反应的是( )
| A. | 淀粉在稀酸作用下转化为葡萄糖 | |
| B. | 乙酸乙酯在氢氧化钠溶液中加热反应 | |
| C. | 葡萄糖在酒化酶作用下转化为乙醇和二氧化碳 | |
| D. | 蛋白质在一定条件下转化为氨基酸 |
 据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构.
据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构. .
.