题目内容
间接碘量滴定法是化学定量分析方法.反应原理为:I2+2S2O32-=2I-+S4O62-.某小组利用该原理测定精致加碘(KIO3)食盐的碘含量.其步骤为:
a.准确称取10.0g食盐加入烧杯中,再加适量蒸馏水使其完全溶解;
b.向溶解后的溶液中加入适量稀硫酸酸化,再加入足量KI溶液,使KIO3与KI反应完全;
c.将步骤b反应后所得溶液全部转入锥形瓶中,并加入合适的物质作指示剂,通过滴定管逐滴加入物质的量浓度为1.0×10-3mol?L-1的Na2S2O3溶液15.00mL,恰好到达滴定终点(视为反应完全);
d.计算实验结果.
(1)下列操作一定会导致Na2S2O3标准溶液配制结果偏高的是
①用托盘天平称量Na2S2O3时砝码放在左盘
②用蒸馏水洗净的容量瓶未经干燥就用于配制溶液
③将烧杯中的溶液转移到容量瓶时不慎撒到容量瓶外
④定容时俯视刻度线
(2)写出实验步骤b中的化学反应方程式
(3)实验步骤c中可选用的指示剂为 ,选用 式(酸、碱)滴定管,到达滴定终点的现象是
(4)根据以上实验测得精制加碘食盐的碘含量(每千克食盐中的碘元素质量)是 mg/kg.
(5)该小组测定步骤的主要缺陷是 .
a.准确称取10.0g食盐加入烧杯中,再加适量蒸馏水使其完全溶解;
b.向溶解后的溶液中加入适量稀硫酸酸化,再加入足量KI溶液,使KIO3与KI反应完全;
c.将步骤b反应后所得溶液全部转入锥形瓶中,并加入合适的物质作指示剂,通过滴定管逐滴加入物质的量浓度为1.0×10-3mol?L-1的Na2S2O3溶液15.00mL,恰好到达滴定终点(视为反应完全);
d.计算实验结果.
(1)下列操作一定会导致Na2S2O3标准溶液配制结果偏高的是
①用托盘天平称量Na2S2O3时砝码放在左盘
②用蒸馏水洗净的容量瓶未经干燥就用于配制溶液
③将烧杯中的溶液转移到容量瓶时不慎撒到容量瓶外
④定容时俯视刻度线
(2)写出实验步骤b中的化学反应方程式
(3)实验步骤c中可选用的指示剂为
(4)根据以上实验测得精制加碘食盐的碘含量(每千克食盐中的碘元素质量)是
(5)该小组测定步骤的主要缺陷是
考点:中和滴定,氧化还原反应
专题:
分析:(1)根据c=
分析误差;
(2)酸性条件下,碘酸根离子和碘离子发生氧化还原反应生成碘单质;
(3)碘遇淀粉溶液变蓝色,当完全反应时,溶液褪色;硫代硫酸钠溶液显碱性,应选择碱式滴定管;
(4)根据硫代硫酸钠和碘之间的关系式计算;
(5)滴定实验一般需重复2-3次.
| n |
| V |
(2)酸性条件下,碘酸根离子和碘离子发生氧化还原反应生成碘单质;
(3)碘遇淀粉溶液变蓝色,当完全反应时,溶液褪色;硫代硫酸钠溶液显碱性,应选择碱式滴定管;
(4)根据硫代硫酸钠和碘之间的关系式计算;
(5)滴定实验一般需重复2-3次.
解答:
解:(1)①称量时药品放在左盘,若使用游码,则称量药品偏少;导致n减少,结果偏低;
②配制过程中需向容量瓶中加水,对结果无影响;
③将烧杯中的溶液转移到容量瓶时不慎撒到容量瓶外,造成溶质减少,结果偏低;
④定容时俯视刻度线,所加水体积减少,V减少,结果偏高;
故答案为:④;
(2)酸性条件下,碘酸钾和碘化钾发生氧化还原反应生成碘单质,反应方程式为KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,
故答案为:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;
(3)溶液中有碘,加入淀粉溶液呈蓝色,碘与亚硫酸钠发生氧化还原反应,当反应终点时,蓝色褪去,硫代硫酸钠溶液显碱性,应选择碱式滴定管;
故答案为:淀粉溶液;碱;当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
(4)有反应方程式:IO3-+5I-+6H+→3I2+3H2O、I2+2S2O32-═2I-+S4O62-,可得关系式:IO3-~3I2~6S2O32-,试样中:n(I)=n(IO3-)=
n(S2O32-)=
×0.001 mol?L-1×15×10-3L=2.5×10-6mol,10.000g食盐含有的碘原子物质的量是2.5×10-6mol,1000g食盐中含有的碘原子的质量是:127g/mol×2.5×10-6mol×100=0.03175g=31.75mg,故答案为:31.75;
(5)为了减少偶然误差,需重复实验2-3次,取平均值,故答案为:作为定量实验应做平行实验2-3次再取平均值.
②配制过程中需向容量瓶中加水,对结果无影响;
③将烧杯中的溶液转移到容量瓶时不慎撒到容量瓶外,造成溶质减少,结果偏低;
④定容时俯视刻度线,所加水体积减少,V减少,结果偏高;
故答案为:④;
(2)酸性条件下,碘酸钾和碘化钾发生氧化还原反应生成碘单质,反应方程式为KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,
故答案为:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;
(3)溶液中有碘,加入淀粉溶液呈蓝色,碘与亚硫酸钠发生氧化还原反应,当反应终点时,蓝色褪去,硫代硫酸钠溶液显碱性,应选择碱式滴定管;
故答案为:淀粉溶液;碱;当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
(4)有反应方程式:IO3-+5I-+6H+→3I2+3H2O、I2+2S2O32-═2I-+S4O62-,可得关系式:IO3-~3I2~6S2O32-,试样中:n(I)=n(IO3-)=
| 1 |
| 6 |
| 1 |
| 6 |
(5)为了减少偶然误差,需重复实验2-3次,取平均值,故答案为:作为定量实验应做平行实验2-3次再取平均值.
点评:本题考查了氧化还原滴定、氧化还原反应的关计算,计算时注意是求食盐中碘的含量不是碘酸钾的含量.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
分析下表中各项的排布规律,有机物X是按此规律排布的第19项,下列有关X的结构和性质说法中一定错误的是
( )
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
| A、是戊酸,同分异构体有4种 |
| B、是酯,在稀硫酸条件下水解的两种产物的相对分子质量不可能相等 |
| C、可以发生银镜反应 |
| D、可以与溴水发生加成反应 |
下列由相关实验现象所推出的结论正确的是( )
| A、向氯水中加入有色布条,片刻后有色布条褪色,说明有Cl2存在 |
| B、向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
| C、Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 |
| D、分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |

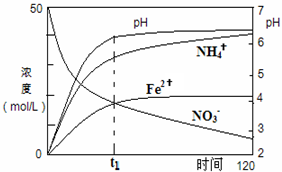 氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.
氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.