题目内容
11.下列溶液中H+的物质的量浓度最大的是( )| A. | 0.1mol/L的硫酸 | B. | 0.1mol/L的硝酸 | ||
| C. | 0.1mol/L的盐酸 | D. | 0.1mol/L的醋酸(CH3COOH) |
分析 硝酸和盐酸都是一元强酸,溶液中氢离子浓度与溶质的浓度相等;硫酸为二元强酸,氢离子浓度是硫酸浓度的2倍,醋酸为弱酸,氢离子浓度小于溶质的浓度,据此进行判断.
解答 解:A.0.1mol/L的H2SO4溶液c(H+)=2mol/L;
B.0.1mol/L的硝酸溶液中c(H+)=0.1mol/L;
C.0.1mol/L的HCl溶液中c(H+)=1mol/L;
D.CH3COOH为弱电解质,c(H+)<0.1mol/L;
根据以上分析可知H+浓度最大的是H2SO4溶液,
故选A.
点评 本题考查物质的量浓度的计算,题目难度不大,注意电解质的强弱判断和一元酸、二元酸的比较,明确物质的量浓度的概念及计算方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列有关离子方程式的书写正确的是( )
| A. | 苯酚钠溶液显碱性:C6H5O-+H2O?C6H5OH+OH- | |
| B. | HSO3-在溶液中发生水解:HSO3-+H2O?SO32-+H3O+ | |
| C. | 向Mg(OH)2浊液中滴加FeCl3溶液生成红褐色沉淀:3OH-+Fe3+=Fe(OH)3↓ | |
| D. | 惰性电极电解MgCl2溶液:Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ OH-+Cl2↑+H2↑ |
2.下列物质中不能用化合反应的方法制得的是( )
①SiO2 ②H2SiO3 ③Fe(OH)3 ④Al(OH)3⑤FeSO4 ⑥CaSiO3.
①SiO2 ②H2SiO3 ③Fe(OH)3 ④Al(OH)3⑤FeSO4 ⑥CaSiO3.
| A. | ②④ | B. | ②④⑤ | C. | ②④⑥ | D. | ②③④⑥ |
6.下列有关说法正确的是( )
| A. | 萃取操作可在长颈漏斗中完成 | |
| B. | 浓烧碱液沾到皮肤上应立即用浓盐酸冲洗 | |
| C. | 可以用药匙向试管中加固体粉末状药品 | |
| D. | 只用烧杯和普通的漏斗就能完成过滤操作 |
16.在试管的内壁附着下列物质,用稀盐酸浸泡而不能除去的是( )
| A. | 用足量一氧化碳还原氧化铁后留下的物质 | |
| B. | 硫酸铁溶液与氢氧化钠溶液反应后留下的红褐色固体 | |
| C. | 盛石灰水后留下的白色固体 | |
| D. | 用足量氢气还原氧化铜后留下的红色物质 |
11.L、M、R、T、W是原子序数依次增大的短周期主族元素,M、T在周期表中的相对位置如表:L与R原子的最外层电子数相同,R的单质是一种常见的半导体材料.请回答下列问题:
(1)T原子的结构示意图为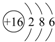 ,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为
,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为 .
.
(2)R是组成玻璃的元素之一,不能用带磨口玻璃塞的试剂瓶放氢氧化钠溶液的原因是(用化学方程式表示)SiO2+2NaOH═Na2SiO3+H2O.
(3)下列有关相应元素非金属性强弱比较的说法,正确的是(填序号)acd.
a.M的气态氢化物比R的气态氢化物稳定,则非金属性M强于R
b.高温下L的单质能从R的最高价氧化物中置换出R,则非金属性L强于R
c.W的核电荷数比T多,原子半径比T小,得电子能力强,则非金属性W强于T
d.同温、同物质的量浓度的Na2LO3和Na2TO4溶液pH:Na2LO3>Na2TO4,则非金属性T强于L
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备RW4,该反应中除RW4外的另一种产物可以用于工业冶炼铁.制备RW4反应的化学方程式为2Cl2+SiO2+2C$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO.
| M | |
| T |
 ,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为
,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为 .
.(2)R是组成玻璃的元素之一,不能用带磨口玻璃塞的试剂瓶放氢氧化钠溶液的原因是(用化学方程式表示)SiO2+2NaOH═Na2SiO3+H2O.
(3)下列有关相应元素非金属性强弱比较的说法,正确的是(填序号)acd.
a.M的气态氢化物比R的气态氢化物稳定,则非金属性M强于R
b.高温下L的单质能从R的最高价氧化物中置换出R,则非金属性L强于R
c.W的核电荷数比T多,原子半径比T小,得电子能力强,则非金属性W强于T
d.同温、同物质的量浓度的Na2LO3和Na2TO4溶液pH:Na2LO3>Na2TO4,则非金属性T强于L
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备RW4,该反应中除RW4外的另一种产物可以用于工业冶炼铁.制备RW4反应的化学方程式为2Cl2+SiO2+2C$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO.
12.下列说法中正确的是( )
| A. | 元素性质的周期性变化是指原子半径、元素的主要化合价及原子核外电子排布的周期性变化 | |
| B. | 元素性质的周期性变化决定于元素原子结构的周期性变化 | |
| C. | 从Li→F,Na→Cl,元素的最高化合价均呈现从+1价→+7价的变化 | |
| D. | 电子总是尽量先排在能量较低的电子层,如排满了K层排L层,排满了M层排N层 |