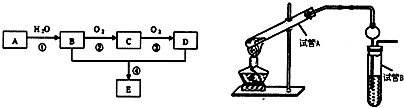
题目内容
下列排列顺序正确的是( )
①热稳定性:HF>H2O>NH3 ②离子半径:Na+>Mg2+>F- ③酸性:盐酸>碳酸>醋酸 ④结合质子能力:OH->CO32->HCO3-.
①热稳定性:HF>H2O>NH3 ②离子半径:Na+>Mg2+>F- ③酸性:盐酸>碳酸>醋酸 ④结合质子能力:OH->CO32->HCO3-.
| A、①③ | B、②④ | C、①④ | D、②③ |
考点:元素周期律和元素周期表的综合应用,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:①非金属性越强,气态氢化物越稳定;
②具有相同排布的离子,原子序数大的离子半径小;
③盐酸与碳酸钠反应生成碳酸,醋酸也与碳酸钠反应生成碳酸;
④对应的酸越强,则酸根离子得到质子的能力越弱.
②具有相同排布的离子,原子序数大的离子半径小;
③盐酸与碳酸钠反应生成碳酸,醋酸也与碳酸钠反应生成碳酸;
④对应的酸越强,则酸根离子得到质子的能力越弱.
解答:
解:①非金属性F>O>N,则气态氢化物的稳定性为HF>H2O>NH3,故正确;
②具有相同排布的离子,原子序数大的离子半径小,则离子半径:F->Na+>Mg2+,故错误;
③盐酸与碳酸钠反应生成碳酸,醋酸也与碳酸钠反应生成碳酸,且盐酸与醋酸钠反应生成醋酸,由强酸制取弱酸的原理可知酸性为盐酸>醋酸>碳酸,故错误;
④酸性为H2CO3>HCO3->H2O,对应的酸越强,则酸根离子得到质子的能力越弱,则结合质子能力:OH->CO32->HCO3-,故正确;
故选C.
②具有相同排布的离子,原子序数大的离子半径小,则离子半径:F->Na+>Mg2+,故错误;
③盐酸与碳酸钠反应生成碳酸,醋酸也与碳酸钠反应生成碳酸,且盐酸与醋酸钠反应生成醋酸,由强酸制取弱酸的原理可知酸性为盐酸>醋酸>碳酸,故错误;
④酸性为H2CO3>HCO3->H2O,对应的酸越强,则酸根离子得到质子的能力越弱,则结合质子能力:OH->CO32->HCO3-,故正确;
故选C.
点评:本题考查元素周期律的递变规律,为高频考点,注意把握元素的性质与对应单质、化合物的性质的关系,题目难度不大,学习中注意积累,侧重微粒性质比较的考查.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
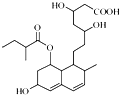 普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )| A、能与FeCl3溶液发生显色反应 |
| B、能使酸性KMnO4溶液褪色 |
| C、1mol该物质与足量钠发生反应生成4molH2 |
| D、1mol该物质最多可与1molNaOH反应 |
N2O5是一种新型硝化剂,一定温度下,在恒压密闭容器中充入4mol NO2、1mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g)达到平衡时,N2O5的浓度为a mol?L-1;若保持其他条件不变,起始时向容器中充入8mol NO2、2mol O2,达到平衡时,N2O5的浓度为( )
A、
| ||
| B、a mol?L-1 | ||
| C、2a mol?L-1 | ||
| D、无法确定 |
下列事实中,不能用平衡移动原理解释的是( )
| A、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| B、工业上合成氨时,为了提高氢气的转化率采用高温的条件 |
| C、实验室中常用排饱和食盐水的方法收集氯气 |
| D、工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
在一定温度下的恒容容器中,当下列物理量不变时,不能表明反应:A(s)+2B(g)?C(g)+D(g)已达到平衡的是( )
| A、混合气体压强 |
| B、混合气体的密度 |
| C、混合气体的平均相对分子质量 |
| D、B的物质的量浓度 |
工业上制取硫酸,回收尾气中的废气常选用的试剂是( )
| A、氨水 |
| B、NaOH |
| C、H2SO4 |
| D、H2SO3 |
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.已知:B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2.由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y,A与C形成的气态化合物Z在标准状况下的密度为0.76g/L,Z溶于水所得溶液为W.下列说法正确的是( )
| A、元素C在周期表中的位置是第三周期第ⅤA族 |
| B、在等体积、等pH的X、Y溶液中分别加入等质量的锌粉,充分反应后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X<Y |
| C、由A、B、C、D四种元素形成的化合物一定只有共价键 |
| D、25℃时,将W溶液与Y溶液等体积混合,充分反应后若pH=7则c(W)>c(Y) |
 如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-═PbSO4
如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-═PbSO4