题目内容
下列事实中,不能用平衡移动原理解释的是( )
| A、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| B、工业上合成氨时,为了提高氢气的转化率采用高温的条件 |
| C、实验室中常用排饱和食盐水的方法收集氯气 |
| D、工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
考点:化学平衡移动原理
专题:化学平衡专题
分析:平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,平衡移动原理对所有的动态平衡都适用.
解答:
解:A.存在平衡H2CO3?H2O+CO2,打开瓶盖时,压强减小,平衡向右移动,二氧化碳气体溶解度减小,逸出二氧化碳,可以用平衡移动原理来解释,故A不选;
B、工业合成氨的反应是放热反应,升高温度化学平衡向着逆反应方向进行,氢气的转化率降低,不可以用平衡移动原理来解释,故B选;
C、氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应,Cl2+H2O?ClO-+2H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,可以勒夏特列原理解释,故C不选;
D、工业上生产硫酸存在平衡2SO2+O2?2SO3,使用过量的空气,增大氧气的浓度,平衡向正反应移动,可提高二氧化硫的利用率,能用勒夏特列原理解释,故D不选
,
故选B.
B、工业合成氨的反应是放热反应,升高温度化学平衡向着逆反应方向进行,氢气的转化率降低,不可以用平衡移动原理来解释,故B选;
C、氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应,Cl2+H2O?ClO-+2H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,可以勒夏特列原理解释,故C不选;
D、工业上生产硫酸存在平衡2SO2+O2?2SO3,使用过量的空气,增大氧气的浓度,平衡向正反应移动,可提高二氧化硫的利用率,能用勒夏特列原理解释,故D不选
,
故选B.
点评:本题考查勒夏特例原理应用的有关判断,是高考中的常见题型和考点,属于中等难度试题的考查.试题难易适中,基础性强,侧重对学生解题能力的培养与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.该题需要明确的应注意区别化学平衡移动原理和化学反应速率理论的应用范围,并能具体问题、具体分析加快.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
现用Pt电极电解1L浓度均为0.1mol/L的HCl、CuSO4的混合液,下列说法正确的是( )
| A、电解开始时,阴极有H2放出 |
| B、电解开始时,阳极上发生:Cu2++2e-═Cu |
| C、当电路中通过电子的量超过0.1mol时,阴极放电的种类将发生变化 |
| D、整个电解过程中,SO42-不参加电极反应 |
将0.1mol?L-1的盐酸逐滴加入体积与物质的量浓度均相等的甲、乙、丙三种溶液中,当溶液呈中性时,消耗盐酸的体积大小顺序为( )
| 甲 | 乙 | 丙 |
| 氨水 | KOH | K2CO3 |
| A、甲>乙>丙 |
| B、乙>甲>丙 |
| C、丙>乙>甲 |
| D、丙>甲>乙 |
下列排列顺序正确的是( )
①热稳定性:HF>H2O>NH3 ②离子半径:Na+>Mg2+>F- ③酸性:盐酸>碳酸>醋酸 ④结合质子能力:OH->CO32->HCO3-.
①热稳定性:HF>H2O>NH3 ②离子半径:Na+>Mg2+>F- ③酸性:盐酸>碳酸>醋酸 ④结合质子能力:OH->CO32->HCO3-.
| A、①③ | B、②④ | C、①④ | D、②③ |
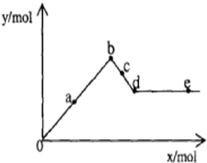 已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )| A、d-e 时溶液中离子的物质的量:Ba2+可能等于AlO2- |
| B、b-c 时溶液中离子的物质的量:AlO2-比Ba2+多 |
| C、a-d 时沉淀的物质的量:Al(OH)3一定小于BaSO4 |
| D、a-b 时沉淀的物质的量:Al(OH)3比BaSO4多 |
用铁片与稀硫酸反应制取氢气时,下列措施能使制取氢气生成速率加大的是( )
| A、降温 |
| B、不用稀硫酸,改用98%的浓硫酸 |
| C、不用稀硫酸,改用稀硝酸 |
| D、滴加少量CuSO4溶液 |