题目内容
4.二氧化氯(ClO2)是一种具有和氯气相似的刺激性气味的气体,沸点为11℃,常温下在水中的溶解度为2.9g/L.它是一种更安全的高效消毒剂,它的氧化能力是氯气的2.5倍,现在已普遍用它替代氯气对自来水进行消毒.目前欧洲和我国主采用Kesting法[原料为氯酸钠(NaClO3)与盐酸]制取ClO2,该法的缺点是同时会产生Cl2.该法制ClO2的化学方程式为:
2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O
(1)用双线桥标出得失电子的数目;
(2)该反应中氧化剂和还原剂的物质的量之比为1:1;
(3)如反应中转移的电子的物质的量为1mol,则标准状况下生成的气体的体积是11.2L.
分析 2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O反应中NaClO3中氯元素化合价+5价变化为+4价为氧化剂,4HCl参加反应有2HCl中氯元素化合价-1价变化为0价为还原剂,电子转移2e-,据此分析解答;
解答 解:(1)反应中HCl为还原剂,被氧化生成氯气,化合价由-1价升高到0价,NaClO3中氯氯元素化合价+5价变化为+4价做氧化剂,电子转移2e-,
用双线桥法标出电子转移的方向和数目为: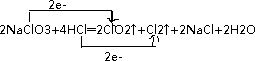
答:用双线桥法标出电子转移的方向和数目为: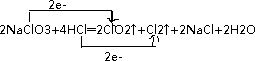 ;
;
(2)2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O反应中NaClO3中氯元素化合价+5价变化为+4价为氧化剂,4HCl参加反应有2HCl中氯元素化合价-1价变化为0价为还原剂,所以氧化剂和还原剂的物质的量之比为2:2=1:1,故答案为:1:1;
(3)根据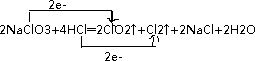 ,则反应中转移的电子的物质的量为1mol,则标准状况下生成的气体的体积是0.5mol×22.4L/mol=11.2L,故答案为:11.2L.
,则反应中转移的电子的物质的量为1mol,则标准状况下生成的气体的体积是0.5mol×22.4L/mol=11.2L,故答案为:11.2L.
点评 本题考查ClO2的制备反应,侧重氧化还原反应的考查,题目难度不大,注意氧化还原反应基本原理的掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列说法正确的是( )
| A. | 铜基态原子核外电子排布式为1s22s22p63s23p64s13d10 | |
| B. | 在d轨道中电子排布成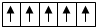 而不是 而不是 ,其最直接的根据是泡利原理 ,其最直接的根据是泡利原理 | |
| C. | 下列轨道的能量是按由高到低排列的E5s>E4s>E3d>E2p>E1s | |
| D. | 焰色反应、激光、霓虹灯光等与原子核外电子发生跃迁释放能量有关 |
9.已知酸性高锰酸钾溶液将硫化铜、硫化亚铜氧化成Cu2+,SO42-,本身被还原成Mn2+.现有CuS和Cu2S组成的混合物的质量为ag,研成粉末完全溶于27mL0.2mol•L-1酸性高锰酸钾溶液(过量)中,充分反应后,滴加15mL0.2mol•L-1硫酸亚铁溶液至恰好完全反应,则a可能等于( )
| A. | 0.288g | B. | 0.366g | C. | 0.384g | D. | 0.396g |
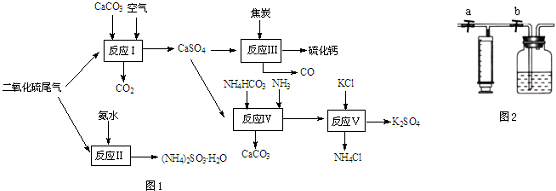
2.硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等,以下是工业利用硫酸钙的部分流程(图1):

(1)工业生产中产生的含SO2废气经石灰吸收和氧化后制成硫酸钙,写出反应方程式2SO2+2Ca(OH)2+O2=2CaSO4+2H2O.
(2)装置Ⅱ中,在一定条件下,二氧化硫和氧气发生反应时,温度与二氧化硫的转化率的关系如表所示:
①该反应的平衡常数表达式K=$\frac{c(SO{\;}_{3}){\;}^{2}}{c(SO{\;}_{2}){\;}^{2}c(O{\;}_{2})}$.
②关于此反应下列说法正确的是ac(填字母).
a.该反应△H<0
b.反应达到平衡时,SO2,O2,SO3 的浓度一定都相等
c.反应达到平衡状态时,v(SO2)正=2v(O2)逆
d.升高温度或使用催化剂都可提高SO2的转化率
③硫酸厂尾气(主要成分为SO2、O2和N2)中低浓度SO2的吸收有很多方法.用氨水吸收上述尾气,若尾气中
SO2与氨水恰好反应得到弱碱性的(NH4)2SO3溶液,则有关该溶液的下列关系正确的是ac (填字母).
a.c(NH4+)+c(NH3•H2O)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
b.c(NH4+)+c (H+)=c (SO32-)+c (HSO3-)+c (OH-)
c.c(NH4+)>c (SO32-)>c (OH-)>c (H+)
(3)装置Ⅲ中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).
已知:①2CO(g)+O2(g)═2CO2(g)△H=-283kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③2CH3OH(l)+3O2(g)═2CO2(g)+4H2O (l)△H=-725.8kJ•mol-1
试写出CO与H2在一定条件下反应生成CH3OH(l)的热化学方程式CO(g)+2H2(g)=CH3OH(l)△H=-350.2kJ•mol-1.
(4)在固态金属氧化物电解池中,一定条件下H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图2所示.
①Y端是电源的正极(填正极或负极).
②阴极的电极反应式为 CO2+2eˉ=CO+O2ˉ和H2O+2e-═H2↑+O2-.

(1)工业生产中产生的含SO2废气经石灰吸收和氧化后制成硫酸钙,写出反应方程式2SO2+2Ca(OH)2+O2=2CaSO4+2H2O.
(2)装置Ⅱ中,在一定条件下,二氧化硫和氧气发生反应时,温度与二氧化硫的转化率的关系如表所示:
| 温度/℃ | 400 | 500 | 600 |
| SO2转化率/% | 99.2 | 93.5 | 73.7 |
②关于此反应下列说法正确的是ac(填字母).
a.该反应△H<0
b.反应达到平衡时,SO2,O2,SO3 的浓度一定都相等
c.反应达到平衡状态时,v(SO2)正=2v(O2)逆
d.升高温度或使用催化剂都可提高SO2的转化率
③硫酸厂尾气(主要成分为SO2、O2和N2)中低浓度SO2的吸收有很多方法.用氨水吸收上述尾气,若尾气中
SO2与氨水恰好反应得到弱碱性的(NH4)2SO3溶液,则有关该溶液的下列关系正确的是ac (填字母).
a.c(NH4+)+c(NH3•H2O)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
b.c(NH4+)+c (H+)=c (SO32-)+c (HSO3-)+c (OH-)
c.c(NH4+)>c (SO32-)>c (OH-)>c (H+)
(3)装置Ⅲ中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).
已知:①2CO(g)+O2(g)═2CO2(g)△H=-283kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③2CH3OH(l)+3O2(g)═2CO2(g)+4H2O (l)△H=-725.8kJ•mol-1
试写出CO与H2在一定条件下反应生成CH3OH(l)的热化学方程式CO(g)+2H2(g)=CH3OH(l)△H=-350.2kJ•mol-1.
(4)在固态金属氧化物电解池中,一定条件下H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图2所示.
①Y端是电源的正极(填正极或负极).
②阴极的电极反应式为 CO2+2eˉ=CO+O2ˉ和H2O+2e-═H2↑+O2-.
 某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步: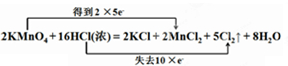 ;
;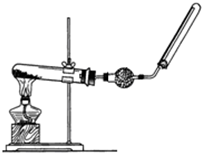 实验室中若用如图所示的装置制取并收集干燥的氨气.
实验室中若用如图所示的装置制取并收集干燥的氨气.