题目内容
15.根据要求完成下列问题(1)用电子式表示氯化钙的形成过程

(2)用系统命名法对烷烃进行命名
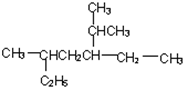 2,5-二甲基-3-乙基-庚烷
2,5-二甲基-3-乙基-庚烷(3)C4H8属于烯烃的同分异构体中有一种结构在和HBr加成时产物只有一种结构,则这种C4H8的结构简式是CH3CH=CHCH3
(4)写出甲苯在一定条件下和H2发生反应的化学方程式
 +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$ .
.
分析 (1)离子化合物中阴离子写出电荷及电性并用“[]”括起来,阳离子写出电荷和电性即可,离子都满足8电子稳定结构;
(2)最长碳链为7个碳原子;
(3)有一种结构在和HBr加成时产物只有一种结构,说明结构对称;
(4)苯环能与氢气加成.
解答 解:(1)氯化钙为离子化合物,用电子式表示下列物质的形成过程为 ,故答案为:
,故答案为: ;
;
(2)最长碳链为7个碳原子, 名称为:2,5-二甲基-3-乙基-庚烷,故答案为:2,5-二甲基-3-乙基-庚烷;
名称为:2,5-二甲基-3-乙基-庚烷,故答案为:2,5-二甲基-3-乙基-庚烷;
(3)有一种结构在和HBr加成时产物只有一种结构,说明结构对称,结构简式是CH3CH=CHCH3,故答案为:CH3CH=CHCH3;
(4)苯环能与氢气加成,化学方程式 +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$ ,故答案为:
,故答案为: +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$ .
.
点评 本题考查了烷烃的命名以及化学方程式的书写,题目难度中等,注意掌握常见有机物的命名原则,烷烃的命名中,正确选取最长碳链为主链是解题关键,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5. 苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸.反应方程式如下:
苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸.反应方程式如下:
 +2KMnO4 $\stackrel{△}{→}$
+2KMnO4 $\stackrel{△}{→}$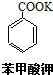 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
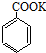 +HCl→
+HCl→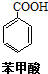 +KCl
+KCl
已知有关化合物的相关数据如表所示:
苯甲酸在100g水中的溶解度:0.18g(4℃),0.27g(18℃),2.2g(75℃).
合成:如图(固定及加热装置略去)所示,在三颈烧瓶中加入4.23mL甲苯和100mL蒸馏水,瓶口装上温度计、电动搅拌器、冷凝管,慢慢开启电动搅拌器,加热至沸腾.经冷凝管上口分批加入21.30g高锰酸钾(过量),继续煮沸至甲苯层消失,回流液中不再出现油珠为止,得到反应混合物.
对反应混合物进行分离:①趁热过滤→②洗涤滤渣→③合并滤液和洗涤液→④冷却→⑤盐酸酸化→⑥过滤.
对粗产品苯甲酸进行提纯:①沸水溶解→②活性炭脱色→③趁热过滤→④冷却结晶→⑤过滤→⑥洗涤→⑦干燥.
请回答下列有关问题:
(1)实验中准确量取4.23mL甲苯所需仪器为酸式滴定管.
(2)冷凝管的上口是否需要塞上塞子否(填“是”或“否”),a处水流方向是进水(填“进水”或“出水”).
(3)高锰酸钾需要分批加入,请用化学反应速率观点说明理由避免反应过快,使反应液从回流管上端喷.
(4)在对粗产品苯甲酸进行提纯过程中,“③趁热过滤”的目的是除去活性炭,减少苯甲酸结晶析出;“④”的操作名称是冷却结晶;可证明“⑥洗涤”步骤已洗涤干净的方法是取最后一次洗涤液,加入用HNO3酸化的AgNO3溶液,若无白色沉淀生成,说明沉淀已洗涤干净.
(5)干燥后称量得苯甲酸2.93g,则苯甲酸的产率为60%.
 苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸.反应方程式如下:
苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸.反应方程式如下: +2KMnO4 $\stackrel{△}{→}$
+2KMnO4 $\stackrel{△}{→}$ +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O  +HCl→
+HCl→ +KCl
+KCl已知有关化合物的相关数据如表所示:
| 化合物 | 相对分子质量 | 密度(g•cm-3) | 溶解性 | 沸点(℃) |
| 甲苯 | 92 | 0.87 | 难溶于水 | 110.0 |
| 苯甲酸钾 | 160 | - | 易溶于水 | - |
| 苯甲酸 | 122 | 1.26 | 微溶于水 | 248.0 |
合成:如图(固定及加热装置略去)所示,在三颈烧瓶中加入4.23mL甲苯和100mL蒸馏水,瓶口装上温度计、电动搅拌器、冷凝管,慢慢开启电动搅拌器,加热至沸腾.经冷凝管上口分批加入21.30g高锰酸钾(过量),继续煮沸至甲苯层消失,回流液中不再出现油珠为止,得到反应混合物.
对反应混合物进行分离:①趁热过滤→②洗涤滤渣→③合并滤液和洗涤液→④冷却→⑤盐酸酸化→⑥过滤.
对粗产品苯甲酸进行提纯:①沸水溶解→②活性炭脱色→③趁热过滤→④冷却结晶→⑤过滤→⑥洗涤→⑦干燥.
请回答下列有关问题:
(1)实验中准确量取4.23mL甲苯所需仪器为酸式滴定管.
(2)冷凝管的上口是否需要塞上塞子否(填“是”或“否”),a处水流方向是进水(填“进水”或“出水”).
(3)高锰酸钾需要分批加入,请用化学反应速率观点说明理由避免反应过快,使反应液从回流管上端喷.
(4)在对粗产品苯甲酸进行提纯过程中,“③趁热过滤”的目的是除去活性炭,减少苯甲酸结晶析出;“④”的操作名称是冷却结晶;可证明“⑥洗涤”步骤已洗涤干净的方法是取最后一次洗涤液,加入用HNO3酸化的AgNO3溶液,若无白色沉淀生成,说明沉淀已洗涤干净.
(5)干燥后称量得苯甲酸2.93g,则苯甲酸的产率为60%.
10.把180mL 2mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了加快反应速率而不影响生成H2的总量,下列措施可行的是( )
| A. | 改用20mL 18mol/L的H2SO4实验 | B. | 反应物中加入少量的硝酸钠固体 | ||
| C. | 反应物中加入少量的硫酸铜固体 | D. | 反应物中加入少量的碳酸钠固体 |
20.某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾.已知电池的总反应为2H2+O2=2H2O,正极反应为O2+2CO2+4e-=2CO32-.下列说法正确的是( )
| A. | 该电池可在常温或高温时工作,对环境有较强的适应性 | |
| B. | 负极反应为H2+2OH--2e-=2H2O | |
| C. | 该电池工作时负极有CO2生成 | |
| D. | 该电池供应2molH2O,同时转移2mol电子 |
7.下列各组排列顺序不正确的是( )
| A. | 热稳定性:碘化氢>溴化氢>氯化氢 | B. | 氧化性:K+<Na+ | ||
| C. | 最高正化合价:氯>硫>磷 | D. | 原子半径:钠>硫>氯 |
5.下列关于硫酸的说法正确的是( )
| A. | 浓硫酸不能干燥碱性气体NH3,也不可干燥CO、H2等还原性气体 | |
| B. | 常温下,铜片和浓硫酸反应产生的气体可使晶红溶液褪色 | |
| C. | 浓硫酸与磁性氧化铁的反应只表现出浓硫酸的酸性 | |
| D. | 蔗糖与浓硫酸的实验过程及现象表现出浓硫酸具有吸水性、脱水性和强氧化性 |