题目内容
20.请回答:Ⅰ:C、N、O、Al、Si、Cu是常见的六种元素.
(1)Si位于元素周期表第三周期第IVA族.
(2)N的基态原子核外电子排布式为1s22s22p3;Cu的基态原子最外层有1个电子.
(3)用“>”或“<”填空:
| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al>Si | N<O | 金刚石>晶体硅 | CH4<SiH4 |
(4)H2O2的电子式
 .
.(5)镁燃烧不能用CO2灭火,用化学方程式表示其理由2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(6)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式AgCl(s)+Br-═AgBr(s)+Cl-.
(7)完成以下氧化还原反应的离子方程式:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
分析 I.(1)主族元素周期数=电子层数、族序数=最外层电子数;
(2)N原子核外有7个电子,结合能量最低原理书写核外电子排布式,Cu原子外围电子排布为3d104s1;
(3)同周期自左而右原子半径减小、电负性增大;
金刚石与晶体硅均为原子晶体,原子半径越小,化学键越稳定,熔点越高;
分子组成和结构相似的分子晶体,相对分子质量越大,沸点越高;
Ⅱ.(4)H2O2中氧原子之间形成1对共用电子对,氧原子与氢原子之间形成1对共用电子对;
(5)Mg在二氧化碳中燃烧生成MgO与碳;
(6)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,说明生成AgBr;
(7)反应中Mn元素化合价由+7价降低为+2价,共降低5价,C元素化合价由+3价升高为+4价,共升高2价,化合价升降最小公倍数为10,可以确定MnO4-的系数为2、C2O42-的系数为5,由原子守恒可知Mn2+的系数为2、CO2的系数为10,由电荷守恒可知,反应物中缺项为H+,由元素守恒可知生成物中缺项为H2O.
解答 解:I.(1)Si原子序数为14,有3个电子层,最外层电子数为4,故Si处于第三周期第IVA族,故答案为:三;IVA;
(2)N原子核外电子数为7,其核外电子排布式为:1s22s22p3,Cu元素为29号元素,处于第四周期IB族,原子外围电子排布为3d104s1,故其最外层电子数为1,
故答案为:1s22s22p3;1;
(3)同周期自左而右原子半径减小、电负性增大,故原子半径Al>Si,电负性:N<O,
金刚石与晶体硅均为原子晶体,由于原子半径C<Si,故C-C键长<Si-Si键长,故C-C键更稳定,故熔点:金刚石>晶体硅;
SiH4、CH4均为分子晶体,相对分子质量越大,沸点越高,由于SiH4相对分子质量大于CH4,故沸点CH4<SiH4,
故答案为:>;<;>;<
Ⅱ.(4)H2O2中氧原子之间形成1对共用电子对,氧原子与氢原子之间形成1对共用电子对,电子式为 ,故答案为:
,故答案为: ;
;
(5)Mg在二氧化碳中燃烧生成MgO与碳,反应方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(6)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,说明生成AgBr,反应离子方程式为:AgCl(s)+Br-═AgBr(s)+Cl-,
故答案为:AgCl(s)+Br-═AgBr(s)+Cl-;
(7)反应中Mn元素化合价由+7价降低为+2价,共降低5价,C元素化合价由+3价升高为+4价,共升高2价,化合价升降最小公倍数为10,可以确定MnO4-的系数为2、C2O42-的系数为5,由原子守恒可知Mn2+的系数为2、CO2的系数为10,由电荷守恒可知,反应物中缺项为H+,由元素守恒可知生成物中缺项为H2O,配平后离子方程式为:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O,
故答案为:2;5;16H+;2;10;8H2O.
点评 本题考查知识点较多,涉及结构与位置关系、核外电子排布、元素周期律、熔沸点比较、电子式、沉淀转化、氧化还原反应配平等,属于拼合型题目,需要学生具备扎实的基础,难度中等.

 阅读快车系列答案
阅读快车系列答案| 编号 | 电极材料 | 电解质溶液 | 电液计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所做的电极(正极或负极)不同(填“相同”或“不同”).
(2)实验3中,铝为负极,电极反应式:2Al-6e-═2Al3+.
(3)实验4中,铝作负极,理由是Al失去电子,写出铝电极的电极反应式Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
| A. | ①②③ | B. | ②③ | C. | ①③④ | D. | ①②④ |
| A. | 根据分散系的稳定性,将分散系分为溶液、胶体和浊液 | |
| B. | 根据是否具有丁达尔效应鉴别蛋白质溶液和氯化钠溶液 | |
| C. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,生成Fe(OH)3胶体 | |
| D. | “纳米材料”是粒子直径为1 nm~100 nm的材料,纳米铜是其中的一种,它是胶体 |
| A. | 能使品红褪色 | |
| B. | 能使湿润的蓝色石蕊试纸变红 | |
| C. | 通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸 | |
| D. | 通入稀溴水中能使溴水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有白色沉淀,该沉淀不溶于硝酸 |


 $\stackrel{△}{→}$
$\stackrel{△}{→}$
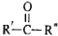 →
→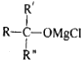 $\stackrel{H_{2}O}{→}$
$\stackrel{H_{2}O}{→}$