题目内容
3.设NA为阿伏伽德罗常数的值.下列有关叙述正确的是( )| A. | 常温常压下,22.4LCCl4含有的分子数为NA | |
| B. | 44gCO2的体积为22.4L | |
| C. | 常温常压下,2NA个H2O分子完全电解,生成O2的体积为22.4L | |
| D. | 标准状况下,33.6LCl2含有1.5个Cl2分子 |
分析 A.气体摩尔体积使用对象为气体;
B.气体状况未知;
C.常温常压Vm>22.4L/mol;
D.依据n=$\frac{V}{Vm}$=$\frac{N}{N{\;}_{A}}$计算解答.
解答 解:A.标况下四氯化碳为液体,不能使用气体摩尔体积,故A错误;
B.气体状况未知,Vm不确定,无法计算气体体积,故B错误;
C.常温常压Vm>22.4L/mol,Vm不确定,无法计算氧气的体积,故C错误;
D.标准状况下,33.6LCl2含有氯气分子个数为:$\frac{33.6L}{22.4L/mol}$×NA=1.5NA个,故D正确;
故选:D.
点评 本题考查了物质的量有关计算,侧重考查气体摩尔体积使用,明确气体摩尔体积概念、使用条件和对象是解题关键,题目难度不大.

练习册系列答案
相关题目
14.下列实验中,操作和现象均正确且能实现相应实验目的是( )
| 选项 | 实验目的 | 操作 | 现象 |
| A | BaSO3难溶于水 | 将SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 |
| B | 验证非金属性:Br>I | 将溴水滴加到淀粉KI溶液中 | 溶液变蓝 |
| C | 验证SO2的漂白性 | 将SO2通入酸性KMnO4溶液中 | KMnO4溶液褪色 |
| D | 验证某化合物一定是钠盐 | 该化合物在酒精灯上灼烧 | 焰色为黄色 |
| A. | A | B. | B | C. | C | D. | D |
11.下列离子方程式中正确的是( )
| A. | Na2O2溶于水:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 向氧化铁中加入氢碘酸发生反应:Fe2O3+6HI═2Fe2++I2+3H2O+4I- | |
| C. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 漂白粉溶液中通入过量的CO2:ClO-+CO2+H2O═HClO+HCO3- |
8.下列关于镁和钠的比较,结论正确的是( )
| A. | 铝镁合金的硬度较大,钠钾合金的硬度较小 | |
| B. | 因为钠的金属性比镁要强,所以钠的熔点比镁要高 | |
| C. | 镁能置换硫酸铜溶液中的铜,钠也能置换硫酸铜溶液中的铜 | |
| D. | 在空气中都能被点燃,生成的产物都是氧化物,氧在产物中的化合价都是-2 |
8.在一密闭容器中,反应aA(g)?bB(g)达到平衡后,保持温度不变,将容器体积扩大一倍,当达到新平衡时B的浓度是原来的60%,则( )
| A. | 平衡向逆反应方向移动 | B. | B的质量分数增加 | ||
| C. | a>b | D. | A的转化率减小 |
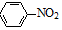 +4Mg+8CH3OH→
+4Mg+8CH3OH→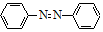 +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
 太原市自2016年11月1日零时起,将汽车用油全部更换为”国V标准”车用燃料,进而 改善太原市空气质量.下列物质中,不会造成空气污染的是( )
太原市自2016年11月1日零时起,将汽车用油全部更换为”国V标准”车用燃料,进而 改善太原市空气质量.下列物质中,不会造成空气污染的是( )