题目内容
某元素X的氧化物很多,其中常见的有A、B两种.
(1)A为黄绿色气体,其中X元素在化合物中化合价为+4价,氧含量为47.44%,可用于漂白木浆和水处理,A在液态和浓缩的气态时具有爆炸性,该气体为 ;
(2)B为黄绿色气体,氧含量为18.41%,当加热或遇电火花时会发生爆炸,该气体为 ;
(3)你认为这两种气体是否可以在防甲型H1N1流感中作为消毒剂? (A.都可以 B.都不可以C.只有气体A可以D.只有气体B可以)
(4)写出气体A与NaOH反应的化学方程式: .由于工业上大量使用的A具有爆炸性,A适宜存放在 (填“酸”或“碱”)性溶液中.
(5)用SO2还原X的+5价的盐,可制得A,写出该反应的离子方程式: .
(1)A为黄绿色气体,其中X元素在化合物中化合价为+4价,氧含量为47.44%,可用于漂白木浆和水处理,A在液态和浓缩的气态时具有爆炸性,该气体为
(2)B为黄绿色气体,氧含量为18.41%,当加热或遇电火花时会发生爆炸,该气体为
(3)你认为这两种气体是否可以在防甲型H1N1流感中作为消毒剂?
(4)写出气体A与NaOH反应的化学方程式:
(5)用SO2还原X的+5价的盐,可制得A,写出该反应的离子方程式:
考点:化学方程式的有关计算
专题:计算题
分析:(1)A可用于漂白木浆和水处理,说明A具有氧化性,根据X元素在化合物中化合价为+4价,设A气体的化学式为XO2,然后根据氧含量为47.44%进行解答;
(2)由(1)可知B为氯的氧化物,根据氧含量为18.41%列式进行解答;
(3)在防甲型H1N1流感中作为消毒剂需具有氧化性,具有高价的元素具有氧化性结合(1)(2)计算的结果进行分析;
(4)A为ClO2,氯元素的价态为+4价,在氢氧化钠溶液中发生歧化反应,生成+5价和+3价的氯的化合物,据此分析选择保存的环境;
(5)X的+5价的盐为ClO3-,用SO2还原,硫的化合价升高为+6价,氯从+5价降为相邻价态+4价,据此分析解答.
(2)由(1)可知B为氯的氧化物,根据氧含量为18.41%列式进行解答;
(3)在防甲型H1N1流感中作为消毒剂需具有氧化性,具有高价的元素具有氧化性结合(1)(2)计算的结果进行分析;
(4)A为ClO2,氯元素的价态为+4价,在氢氧化钠溶液中发生歧化反应,生成+5价和+3价的氯的化合物,据此分析选择保存的环境;
(5)X的+5价的盐为ClO3-,用SO2还原,硫的化合价升高为+6价,氯从+5价降为相邻价态+4价,据此分析解答.
解答:
解:(1)根据题意设A气体的化学式为XO2,X的相对原子质量为MM,则
×100%=47.44%,解得:MM=35.5,X为氯元素,A的化学式为ClO2,
故答案为:ClO2;
(2)设B气体的化学式为ClmOn,根据题意有:
×100%=18.41%,n=1,m=2时符合题意,所以B气体为Cl2O,
故答案为:Cl2O;
(3)由(1)(2)计算的结果可知,A、B中的氯元素的价态分别为+4和+1价,均处于较高价,所以二者均具有氧化性,故它们都可以作为防SARS的消毒剂,
故选:A;
(4)由题意可知该反应的反应物为ClO2和NaOH,+4价的氯元素在氢氧化钠溶液中发生歧化反应,产物为相邻价态的元素+3价和+5价,所以产物为:NaClO2、NaClO3和H2O,根据化合价升降法配平得:2ClO2+2NaOH═NaClO2+NaClO3+H2O,A具有爆炸性,A适宜存放在碱性环境中,
故答案为:2ClO2+2NaOH═NaClO2+NaClO3+H2O;碱;
(5)A为ClO2,Cl为+4价,X的+5价的盐为ClO3-,用SO2还原,硫的化合价升高为+6价,所以反应物为:SO2、ClO3-,氯从+5价降为相邻价态+4价,所以生成物为:ClO2、SO42-,所以发生反应为:SO2+2ClO3-=2ClO2+SO42-,
故答案为:SO2+2ClO3-=2ClO2+SO42-.
| 16×2 |
| M+16×2 |
故答案为:ClO2;
(2)设B气体的化学式为ClmOn,根据题意有:
| 16n |
| 35.5m+16n |
故答案为:Cl2O;
(3)由(1)(2)计算的结果可知,A、B中的氯元素的价态分别为+4和+1价,均处于较高价,所以二者均具有氧化性,故它们都可以作为防SARS的消毒剂,
故选:A;
(4)由题意可知该反应的反应物为ClO2和NaOH,+4价的氯元素在氢氧化钠溶液中发生歧化反应,产物为相邻价态的元素+3价和+5价,所以产物为:NaClO2、NaClO3和H2O,根据化合价升降法配平得:2ClO2+2NaOH═NaClO2+NaClO3+H2O,A具有爆炸性,A适宜存放在碱性环境中,
故答案为:2ClO2+2NaOH═NaClO2+NaClO3+H2O;碱;
(5)A为ClO2,Cl为+4价,X的+5价的盐为ClO3-,用SO2还原,硫的化合价升高为+6价,所以反应物为:SO2、ClO3-,氯从+5价降为相邻价态+4价,所以生成物为:ClO2、SO42-,所以发生反应为:SO2+2ClO3-=2ClO2+SO42-,
故答案为:SO2+2ClO3-=2ClO2+SO42-.
点评:本题主要考查了氯的氧化物的性质,根据题干信息结合氧化还原知识是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
下列表示方法错误的是( )
A、氮分子的电子式: |
B、Cl-的离子结构示意图: |
C、甲烷分子的比例模型: |
D、乙烯分子的球棍模型: |
下列说法正确的是( )
| A、醋酸在醋酸钠溶液中电离程度大于在纯水中电离程度 | ||
| B、常温下0.1mol?L-1醋酸溶液的pH=a,加入适量的醋酸钠固体,能使溶液的pH=(a+1) | ||
| C、常温下由0.1mol?L-1一元碱BOH溶液的pH=10,推知该溶液中存在BOH=B++OH- | ||
D、向0.1mol?L-1的氨水中加入少量硫酸铵固体,则溶液中
|
两种气态烃组成的混合气体0.1mol,完全燃烧得0.16mol CO2和3.6g水,下列说法正确的是( )
| A、混和气体中一定有CH4 |
| B、混和气体中一定有甲烷和乙烯 |
| C、混和气体中一定没有乙烷 |
| D、混和气体中一定有乙炔 |
标准状况下,1.12L CH4和C2H4的混合气体通入足量溴水中,溴水增重0.28克,则乙烯占混合气体的体积分数为( )
| A、20% | B、40% |
| C、60% | D、80% |
油脂皂化反应后使肥皂和甘油充分分离,这种分离方法及该方法属于( )
| A、盐析 化学变化 |
| B、萃取 物理变化 |
| C、盐析 物理变化 |
| D、蒸馏 物理变化 |
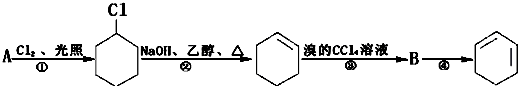
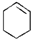 具有的性质叙述正确的是
具有的性质叙述正确的是