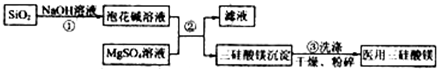
题目内容
7.下列说法不正确的是( )| A. | 常温下,醋酸钠与醋酸的混合溶液pH=7,c(Na+)=c(CH3COO-) | |
| B. | 常温下,将pH=1的醋酸溶液稀释100倍后,水电离的c(H+)=10-11mol/L | |
| C. | 0.1 mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| D. | 0.1mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
分析 A、常温下,醋酸钠与醋酸的混合溶液pH=7,氢离子和氢氧根离子浓度相等,根据电荷守恒来回答;
B、将pH=1的醋酸溶液稀释100倍后,其pH<3;
C、0.1 mol/L Na2CO3溶液中存在质子守恒,据此回答;
D、NaHCO3溶液中存在电荷守恒,据此回答计算.
解答 解:A、常温下,醋酸钠与醋酸的混合溶液pH=7,氢离子和氢氧根离子浓度相等,根据电荷守恒,c(Na+)=c(CH3COO-),故A正确;
B、将pH=1的醋酸溶液稀释100倍后,其pH<3,水电离的c(H+)>10-11mol/L,故B错误;
C、0.1 mol/L Na2CO3溶液中存在质子守恒c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故C正确;
D、NaHCO3溶液中存在电荷守恒:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故D正确.
故选B.
点评 本题考查学生溶液中离子浓度之间的关系以及三大守恒等方面的知识,属于综合知识的考查,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.配制一定物质的量浓度的氢氧化钠溶液时,结果所配溶液浓度偏高,其原因可能是( )
| A. | 所用氢氧化钠已经潮解 | |
| B. | 向容量瓶中加水未到刻度线 | |
| C. | 有少量的氢氧化钠残留在烧杯中 | |
| D. | 用带游码的托盘天平称2.4g氢氧化钠时误用了“左码右物”的操作 |
18.1mol C2H4与Cl2完全加成,再与Cl2彻底取代,两过程共用Cl2( )
| A. | 2 mol | B. | 4mol | C. | 5mol | D. | 6mol |
12.关于合金的下列说法不正确的是( )
| A. | 合金具备金属的特性 | |
| B. | 合金的硬度一般比其组成成分金属的硬度大 | |
| C. | 合金的熔点一般比其组成成分的熔点低 | |
| D. | 合金只能由两种或两种以上的金属组成 |
19.某1.6g有机物燃烧后的产物先通过浓H2SO4,浓H2SO4增重3.6g,后又通过碱石灰、碱石灰增重4.4g,下列说法正确的是( )
| A. | 浓H2SO4增重的是CO2的质量 | B. | 该有机物中没有氧元素 | ||
| C. | 该有机物中有氧元素 | D. | 碱石灰增重的是CO2和H2O的质量 |
17.测得某无色透明溶液的pH=2,则在该溶液中能大量共存的离子是( )
| A. | Na+ Cl- Mg2+ SO42- | B. | K+ Cu2+ I- SO42- | ||
| C. | NO3- K+ Cl- OH- | D. | Al3+ Na+ S2- Cl- |
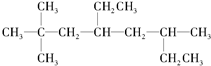 烃A的一氯代物具有不同沸点的产物有10种.
烃A的一氯代物具有不同沸点的产物有10种.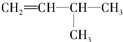 的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.
的系统名称是3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷. 的分子式为C4H8O;
的分子式为C4H8O; 名称为:1,2-二甲基苯(或邻二甲苯).
名称为:1,2-二甲基苯(或邻二甲苯).