题目内容
4.下列有关性质的比较,不能用元素周期律解释的是( )| A. | 酸性:H2SO4>H3PO4 | B. | 非金属性:O>S | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 沸点:HF>HCl |
分析 A.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
B.同主族元素从上到下非金属性依次减弱;
C.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
D.在卤化氢中,HF分子之间存在氢键,沸点最高.
解答 解:A.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性:S>P,则酸性:H2SO4>H3PO4,能用元素周期律解释,故A不选;
B.氧和硫两种元素同属于第ⅥA族,同主族元素从上到下非金属性依次减弱,则非金属性:O>S,能用元素周期律解释,故B不选;
C.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,金属性:Na>Mg,则碱性:NaOH>Mg(OH)2,能用元素周期律解释,故C不选;
D.HF分子之间存在氢键,沸点最高,所以沸点:HF>HCl,不能用元素周期律解释,故D选;
故选D.
点评 本题考查了元素周期律的理解与应用,注意把握元素周期律的递变规律以及相关知识的积累,题目难度不大,注意分子晶体沸点与氢键有关.

练习册系列答案
相关题目
14.下列实验方法或操作正确的是( )
| A. |  转移溶液 | B. |  制蒸馏水 | C. |  分离水和酒精 | D. |  稀释浓硫酸 |
15.下列图示与对应的叙述不相符的是( )
| A. |  表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3不饱和溶液 | |
| B. |  表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. |  表示0.1000mol/LNaOH滴定20.00 mL 0.1000mol/L醋酸的滴定曲线 | |
| D. |  表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,体积V与沉淀n的变化 |
12.结构片段为…-CH=CH-CH=CH-…的高分子化合物的单体是( )
| A. | 乙烯 | B. | 乙炔 | C. | 正丁烯 | D. | 1,3-丁二烯 |
19.根据下列所给出的数据,得出的结论正确的是( )
| A. | 在10%的NaOH溶液中,平均每9个水分子溶有1个OHˉ | |
| B. | 将10g碳酸钙粉末加水配制成100mL溶液,CaCO3的物质的量浓度为1mol/L | |
| C. | 通入标准状况下11.2LHCl气体,可使1L 0.5mol/L的盐酸的物质的量浓度增大一倍 | |
| D. | 已知某氢氧化钠溶液中Na+与H2O的个数之比为1:a,则可求出此溶液中氢氧化钠的质量分数$\frac{20}{20+9a}$ |
9.把100mL含有MgSO4和K2SO4的混合溶液分成二等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为( )
| A. | 20(2b-a) mol/L | B. | 20(b-2a) mol/L | C. | 10(2b-a) mol/L | D. | 10(b-2a) mol/L |
16.如图所示的实验,能达到实验目的是( )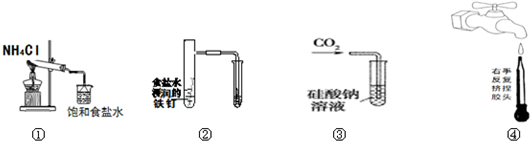

| A. | 实验①制取的氨气溶解在饱和NaCl溶液 | |
| B. | 实验②通过观察右边试管有无倒吸现象说明铁钉是否发生吸氧腐蚀 | |
| C. | 实验③可用于证明碳的非金属性比硅强 | |
| D. | 图④是实验室洗涤胶头滴管的操作 |
13.已知25%的A溶液的密度为ρ1,5%的A溶液的密度为ρ2,若将上述两种溶液等体积混合后,所得A溶液的质量分数小于15%,则下列关于ρ1和ρ2关系的表达正确的是( )
| A. | ρ1<ρ2 | B. | ρ1=ρ2 | C. | ρ1>ρ2 | D. | 无法估算 |
14.某有机物的结构简式如图所示,有关该有机物的叙述正确的是( )


| A. | 分子中含有3 种官能团 | |
| B. | 在一定条件下,能发生取代、氧化、酯化和加聚反应 | |
| C. | 该物质分子中最多可以有10 个碳原子在同一平面上 | |
| D. | 1 mol 该物质最多可与5 mol H2发生加成反应 |