题目内容
9.下列说法正确的是( )| A. | 日常利用的煤、天然气、石油等的能量,归根到底是由太阳能转变来的 | |
| B. | 等质量的白磷蒸气和白磷固体分别完全燃烧,后者放出的热量多 | |
| C. | 燃烧热是指1 mol任何物质完全燃烧生成稳定氧化物所放出的热量 | |
| D. | H+ (aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1表示强酸溶液与强碱溶液反应的中和热 |
分析 A.煤、天然气、石油等的能量,为化石能源,能量来源于太阳能;
B.同种物质的气态比固态能量高,燃烧为放热反应;
C.1mol纯物质完全燃烧生成稳定氧化物所放出的热量为燃烧热;
D.稀的强酸、强碱生成1mol水时放热为57.3 kJ.
解答 解:A.煤、天然气、石油等的能量,为化石能源,能量来源于太阳能,则日常利用的煤、天然气、石油等的能量,归根到底是由太阳能转变来的,故A正确;
B.同种物质的气态比固态能量高,燃烧为放热反应,则等质量的白磷蒸气和白磷固体分别完全燃烧,前者放出的热量多,故B错误;
C.1mol纯物质完全燃烧生成稳定氧化物所放出的热量为燃烧热,如1molCO和氢气的混合物燃烧放出热量不是燃烧热,故C错误;
D.稀的强酸、强碱生成1mol水时放热为57.3 kJ,若浓硫酸与NaOH反应生成1mol水放出热量不是57.3kJ,故D错误;
故选A.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、燃烧热与中和热的理解为解答的关键,侧重分析与应用能力的考查,注意选项CD为易错点,题目难度不大.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
19.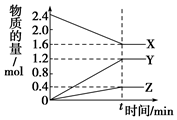 一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.下列说法正确的是( )
一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.下列说法正确的是( )
 一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.下列说法正确的是( )
一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态.下列说法正确的是( )| A. | 该反应的化学方程式为:2X?3Y+Z | |
| B. | 10s内Y的平均速率为0.12 mol•L-1•min-1 | |
| C. | X的转化率为66.7% | |
| D. | 增大压强,该反应速率一定加快 |
20.下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
①SO2②CH3CH2CH═CH2③ ④CH3CH3.
④CH3CH3.
①SO2②CH3CH2CH═CH2③
 ④CH3CH3.
④CH3CH3.| A. | ①② | B. | ③④ | C. | ①②④ | D. | ①②③④ |
17.目前,全球有16亿人有不同程度的缺碘现象,其中包括6亿儿童.科研表明,人的一生只要能摄入一小茶匙的碘就能正常发育,健康生活.目前预防缺碘的有效办法是食用含碘食盐.这种食盐含( )
| A. | 单质碘(I2) | B. | 碘化钠中化合态的碘(I-) | ||
| C. | 碘酸钠中的碘元素 | D. | 氯化碘(ICl)中的碘元素 |
4. 二甲醚又称甲醚,熔点-141.5℃,沸点-24.9℃,与石油液化气相似,被誉为“21世纪的清洁燃料”.制备原理如下:
二甲醚又称甲醚,熔点-141.5℃,沸点-24.9℃,与石油液化气相似,被誉为“21世纪的清洁燃料”.制备原理如下:
I.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)?CH3OCH3(g)+H2O(g)△H1=-283.6kJ•mol-1
II.由合成气制备二甲醚:
②CO(g)+2H2(g)?CH3OH(g)△H2=-90.7kJ•mol-1
③2CH3OH(g)?CH3OCH3(g)+H2O(g)△H3
(1)反应③中的相关的化学键键能数据如表:
则△H3=-24kJ•mol-1
(2)下列能表明反应①达到化学平衡状态的是bd.
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)原理I中,在恒温、恒容的密闭容器中,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是b.
(4)有人模拟原理II,500K时,在2L的密闭容器中充入2molCO和6molH2,平衡时CO的转化率为80%,c(CH3OCH3)=0.3mol•L-1,可逆反应③的平衡常数K3=2.25.在500K时,若容器中n(CH3OH)=n(CH3OCH3),某同学通过计算,得浓度商Qc的值小于K3,则此时反应③中v(正)大于v(逆)(填“大于”或“小于”).
(5)原理II中,为提高二甲醚的产率,可以采取的一种措施是增大压强(或降低温度等).
 二甲醚又称甲醚,熔点-141.5℃,沸点-24.9℃,与石油液化气相似,被誉为“21世纪的清洁燃料”.制备原理如下:
二甲醚又称甲醚,熔点-141.5℃,沸点-24.9℃,与石油液化气相似,被誉为“21世纪的清洁燃料”.制备原理如下:I.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)?CH3OCH3(g)+H2O(g)△H1=-283.6kJ•mol-1
II.由合成气制备二甲醚:
②CO(g)+2H2(g)?CH3OH(g)△H2=-90.7kJ•mol-1
③2CH3OH(g)?CH3OCH3(g)+H2O(g)△H3
(1)反应③中的相关的化学键键能数据如表:
| 化学键 | C-O | H-O(水) | H-O(醇) | C-H |
| E/(kJ.mol-1) | 343 | 465 | 453 | 413 |
(2)下列能表明反应①达到化学平衡状态的是bd.
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)原理I中,在恒温、恒容的密闭容器中,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是b.
(4)有人模拟原理II,500K时,在2L的密闭容器中充入2molCO和6molH2,平衡时CO的转化率为80%,c(CH3OCH3)=0.3mol•L-1,可逆反应③的平衡常数K3=2.25.在500K时,若容器中n(CH3OH)=n(CH3OCH3),某同学通过计算,得浓度商Qc的值小于K3,则此时反应③中v(正)大于v(逆)(填“大于”或“小于”).
(5)原理II中,为提高二甲醚的产率,可以采取的一种措施是增大压强(或降低温度等).
14.某种混合气可能含有N2、HCl和CO.把混合气体依次通过足量的NaHCO3灼热的CuO,气体体积都没有变化,再通过足量的Na2O2固体,气体体积减少,最后通过灼热的铜网,经充分反应后气体体积又减小,但还有剩余气体,下列对混合气体组分的判断,正确的是( )
| A. | 一定有N2、CO和HCl | B. | 一定有N2,CO和HCl中至少有一种 | ||
| C. | 一定有N2和HCl | D. | 一定有N2和CO |
1.向复盐明矾[KAl(SO4)2•12H2O]溶液中滴加Ba(OH)2溶液,使SO42-恰好完全沉淀,反应的离子方程式正确的是( )
| A. | Ba2++SO42-=BaSO4↓ | |
| B. | 2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ | |
| C. | Al3++2SO42-+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓ | |
| D. | Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |