题目内容
A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F为红褐色沉淀.
请填写下列空白:
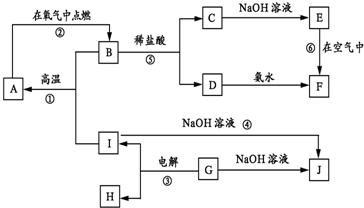
(1)A、B、C、D、E、F六种物质中所含的同一种元素是 (写元素符号).
(2)写出物质C、G的化学式:C ,G .
(3)写出反应①、④的化学方程式:反应①: .反应④: .
请填写下列空白:

(1)A、B、C、D、E、F六种物质中所含的同一种元素是
(2)写出物质C、G的化学式:C
(3)写出反应①、④的化学方程式:反应①:
考点:无机物的推断
专题:推断题
分析:G是一种两性氧化物,应为Al2O3,与NaOH反应生成NaAlO2,则J为NaAlO2,电解生成O2和Al,由反应④可知,I为Al,则H为O2,F为红褐色沉淀,则应为Fe(OH)3,则D为FeCl3,E为Fe(OH)2,C为FeCl2,所以B为Fe3O4,与Al在高温下发生铝热反应生成A,A为Fe,根据物质的性质可进一步书写有关反应的化学方程式.
解答:
解:(1)G是一种两性氧化物,应为Al2O3,与NaOH反应生成NaAlO2,则J为NaAlO2,电解生成O2和Al,由反应④可知,I为Al,则H为O2,F为红褐色沉淀,则应为Fe(OH)3,则D为FeCl3,E为Fe(OH)2,C为FeCl2,所以B为Fe3O4,与Al在高温下发生铝热反应生成A,A为Fe,所以A、B、C、D、E、F六种物质中所含的同一种元素是Fe,故答案为:Fe;
(2)由(1)分析可知,C为FeCl2,G为Al2O3,故答案为:FeCl2;Al2O3;
(3)反应①为Fe3O4与Al在高温下发生反应生成Fe与氧化铝,反应的方程式为:8Al+3Fe3O4
9Fe+4Al2O3,
反应④为Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应的方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
故答案为:8Al+3Fe3O4
9Fe+4Al2O3;2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(2)由(1)分析可知,C为FeCl2,G为Al2O3,故答案为:FeCl2;Al2O3;
(3)反应①为Fe3O4与Al在高温下发生反应生成Fe与氧化铝,反应的方程式为:8Al+3Fe3O4
| ||
反应④为Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应的方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
故答案为:8Al+3Fe3O4
| ||
点评:本题考查无机物的推断,涉及Fe、Al元素单质化合物性质,注意根据物质的性质和典型反应用逆推的方法推断,题目难度中等.

练习册系列答案
相关题目
某有机物能跟新制的氢氧化铜反应生成红色沉淀,相对分子质量为44.燃烧该有机物2.2g生成2.24L(标准状况)CO2.下列说法不正确的是( )
| A、该有机物属于醛类 |
| B、1mol该有机物一定条件下能与1mol H2加成 |
| C、燃烧该有机物4.4g,生成1.8g水 |
| D、0.01mol该有机物与足量银氨溶液充分反应,析出金属银2.16g |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中不正确的是( )
| A、氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH- | ||||
B、用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液的离子方程式为:2C1-+2H2O
| ||||
| C、粗铜精炼时,与电源负极相连的是纯铜,电极反应式为:Cu2++2e-=Cu | ||||
| D、钢铁发生电化学腐蚀的负极反应式:Fe-2e-=Fe2+ |
 如图所示,常温下电解5min后,Cu电极质量增加2.16g.
如图所示,常温下电解5min后,Cu电极质量增加2.16g. 如图所示:已知A和E为金属单质,B是化合物且常温下为液态,C具有磁性,F为两性化合物.按要求回答下列问题:
如图所示:已知A和E为金属单质,B是化合物且常温下为液态,C具有磁性,F为两性化合物.按要求回答下列问题: