题目内容
(1)配离子[Cu(H2O)4]2+的名称为 .
(2)金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁).形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18.金属羰基配合物中,微粒间作用力有 (填字母代号).
A、离子键 B、共价键 C、配位键 D、金属键
羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃.由此推测,固体羰基铁更接近于
(填晶体类型).若用Fe(CO)x表示羰基铁的化学式,则x= .
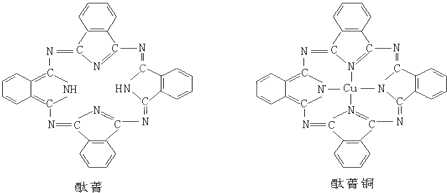
(3)酞菁与酞菁铜染料分子结构如图所示:酞菁分子中氮原子采用的杂化方式有: ,并在下图相应位置上标出酞菁铜结构中铜原子形成的配位键:
(4)研究表明,对于中心离子为Hg2+等阳离子的配合物,若配位体给出电子能力越强,则配位体与中心离子形成的配位键就越强,配合物也就越稳定.预测HgCl42-与HgI42-的稳定性强弱:
HgCl42-比HgI42-更 (填“稳定”或“不稳定”).
(2)金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁).形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18.金属羰基配合物中,微粒间作用力有
A、离子键 B、共价键 C、配位键 D、金属键
羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃.由此推测,固体羰基铁更接近于
(3)酞菁与酞菁铜染料分子结构如图所示:酞菁分子中氮原子采用的杂化方式有:

(4)研究表明,对于中心离子为Hg2+等阳离子的配合物,若配位体给出电子能力越强,则配位体与中心离子形成的配位键就越强,配合物也就越稳定.预测HgCl42-与HgI42-的稳定性强弱:
HgCl42-比HgI42-更
考点:配合物的成键情况,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)根据配合物的命名规则命名,配离子[Cu(H2O)4]2+的名称为四水合铜离子;
(2)金属羰基配合物中应含有配位键,羰基中含有共价键;羰基铁沸点低,应为分子晶体,根据羰基铁中铁能提供的空轨道判断配位数;
(3)由结构式中的键和孤电子对数判断氮原子采用的杂化方式;根据结构直接去标出酞菁铜结构中铜原子形成的配位键;
(4)配位键越弱,配合物越不稳定,配位键的强弱取决于元素的非金属性强弱.
(2)金属羰基配合物中应含有配位键,羰基中含有共价键;羰基铁沸点低,应为分子晶体,根据羰基铁中铁能提供的空轨道判断配位数;
(3)由结构式中的键和孤电子对数判断氮原子采用的杂化方式;根据结构直接去标出酞菁铜结构中铜原子形成的配位键;
(4)配位键越弱,配合物越不稳定,配位键的强弱取决于元素的非金属性强弱.
解答:
解:(1)根据配合物的命名规则命名,配离子[Cu(H2O)4]2+的名称为四水合铜离子,故答案为:四水合铜离子;
(2)金属羰基配合物中应含有配位键,羰基中含有共价键,羰基铁沸点低,应为分子晶体,羰基铁中铁能提供的空轨道数为5,故答案为:BC或BCD;分子晶体;5;
(3)酞菁分子中部分氮原子含有2个σ键一个孤对电子,所以采取sp2杂化,部分氮原子含有3个σ键一个孤对电子,所以采取sp3杂化;该分子中能提供孤对电子的氮原子才是配原子,所以画出的配位键为上下两个氮原子向铜原子提供孤电子对,为 ,
,
故答案为:sp3和sp2; ;
;
(4)根据配位体给出电子能力越强:则配位体与中心离子形成的配位键就越强,配合物也就越稳定可知I给出电子的能力大于Cl,即元素的非金属性越弱,配位键越强,故答案为:不稳定.
(2)金属羰基配合物中应含有配位键,羰基中含有共价键,羰基铁沸点低,应为分子晶体,羰基铁中铁能提供的空轨道数为5,故答案为:BC或BCD;分子晶体;5;
(3)酞菁分子中部分氮原子含有2个σ键一个孤对电子,所以采取sp2杂化,部分氮原子含有3个σ键一个孤对电子,所以采取sp3杂化;该分子中能提供孤对电子的氮原子才是配原子,所以画出的配位键为上下两个氮原子向铜原子提供孤电子对,为
 ,
,故答案为:sp3和sp2;
 ;
;(4)根据配位体给出电子能力越强:则配位体与中心离子形成的配位键就越强,配合物也就越稳定可知I给出电子的能力大于Cl,即元素的非金属性越弱,配位键越强,故答案为:不稳定.
点评:本题考查配合物知识,题目难度较大,本题考查共价键的类型、杂化类型晶体类型等,注意解答问题的方法的积累.注意形成配位键的本质、配位数的确定方法和确定中心原子的杂化类型,这些都是高考的重点.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
下列变化属于物理变化的是( )
| A、煤的干馏 | B、石油的分馏 |
| C、重油的裂化 | D、石油的裂解 |
以下原子能产生发射光谱的是( )
| A、1s22s1 |
| B、1s22s22p1 |
| C、1s22s12p2 |
| D、1s22s22p3 |
下列离子可以大量共存的是( )
| A、K+、SO42-、OH-、AlO2- |
| B、K+、Ag+、Cl-、NO3- |
| C、Ba2+、Na+、OH-、CO32- |
| D、Na+、NH4+、NO3-、OH- |
塑料的使用大大方便了人类的生活,但由此也带来了严重的“白色污染”.下列对废弃塑料制品的处理方法中最为恰当的是( )
| A、焚烧 |
| B、粉碎后深埋 |
| C、倾倒在海洋中 |
| D、用化学方法加工成防水涂料或汽油 |
 如图所示,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.
如图所示,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.
 系统命名为
系统命名为 的炔烃的结构简式
的炔烃的结构简式