题目内容
17.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 23 g钠在氧气中完全燃烧失电子数为0.5NA | |
| B. | 46gNO2和N2O4混合气体中含有氮原子数为1NA~2NA | |
| C. | 1 mol Cl2参加反应转移电子数可能为2NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol/L |
分析 A、依据n=$\frac{m}{M}$计算物质的量,结合钠原子结构计算失电子数;
B.NO2和N2O4的最简式相同为NO2,计算46g NO2中所含氮原子数;
C.氯气参加反应,表现性质不同,转移电子数不同,只做氧化剂电子转移2e-,既做氧化剂也做还原剂电子转移不是2e-,例如氯气和水的反应、氯气和碱的反应等;
D.0.5mol氧化钠溶于1L水中,溶液的体积未知,不能计算浓度;
解答 解:A、23g钠物质的量=$\frac{23g}{23g/mol}$=1mol,在氧气中完全燃烧失电子数为NA ,故A错误;
B.NO2和N2O4的最简式相同为NO2,计算46g NO2中所含氮原子数=$\frac{46g}{46g/mol}$×1×NA=NA,故B错误;
C.氯气参加反应,表现性质不同,转移电子数不同,例如氯气与水反应生成盐酸和次氯酸,Cl元素的化合价由0升高为+1价,Cl元素的化合价由0降低为-1价,1mol Cl2参加反应转移电子数为NA;
1mol Cl2与铁反应生成氯化铁,氯气全部做氧化剂,1mol Cl2参加反应转移电子数为2NA;
所以1mol Cl2参加反应转移电子数可能为2NA.故C正确;
D.含NA个Na+的Na2O,物质的量为0.5mol,溶解于1L水中,溶液的体积无法计算,不能知道氢氧化钠的物质的量浓度,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确气体摩尔体积的条件应用是解题关键,题目难度不大.

练习册系列答案
相关题目
8.用氯气制漂白粉的主要目的是( )
| A. | 提高氯的质量分数 | B. | 增强漂白能力 | ||
| C. | 转变为很易溶于水的物质 | D. | 转变为较稳定,便于贮存的物质 |
5.下列叙述不正确的是( )
| A. | 为防止氯化亚铁溶液变质,在氯化亚铁溶液中加铁粉 | |
| B. | 二氧化硫和二氧化氮都能形成酸雨,酸雨的pH小于5.6 | |
| C. | 用铁片区分浓硫酸和稀硫酸 | |
| D. | 用干燥的红色石蕊试纸检验氨气 |
2.下列各组物质的分类都正确的是(括号里的是类别)( )
| A. | 空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质) | |
| B. | 液氨(纯净物)、NH4Cl(铵盐)、HNO3(含氧酸)、NaOH(电解质) | |
| C. | HCl(共价化合物)、CH3CHO(羧酸)、CO(酸性氧化物)、CH3I(卤代烃) | |
| D. | NO2(氧化物)、NH4Cl(强碱弱酸盐)、CO(有机物)、CH3COOCH3(酯) |
6.一定温度下,恒容容器中发生可逆反应C(s)+2H2O(g)═CO2(g)+2H2(g),一定能说明该反应已达到平衡状态的是( )
| A. | 生成1molCO2的同时消耗2molH2O | B. | n(H2O):n(H2)=1:1 | ||
| C. | 2v正(H2O)=v逆(CO2) | D. | 容器中气体的压强不发生变化 |
 ③CH3CH2Br④
③CH3CH2Br④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨ ⑩
⑩
 表示的有机物的分子式C6H14;
表示的有机物的分子式C6H14; 中含有的官能团的名称为酚羟基、酯基.
中含有的官能团的名称为酚羟基、酯基.
 .
.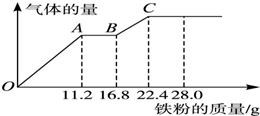 某稀硫酸和稀硝酸的混合溶液200mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.
某稀硫酸和稀硝酸的混合溶液200mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.