题目内容
5.下列说法正确的是( )| A. | 金属镁着火时,可用CO2灭火器进行灭火 | |
| B. | 用淀粉碘化钾溶液能区分NO2和溴蒸气 | |
| C. | 通常情况下,氮气的性质很不活泼 | |
| D. | 一氧化氮是一种红棕色气体 |
分析 A.镁可以在二氧化碳中燃烧;
B.NO2和Br2蒸气均能氧化KI中的碘离子生成碘单质;
C.氮气分子内部存在氮氮三键,键能很高;
D.NO为无色气体.
解答 解:A.镁可以在二氧化碳中燃烧,所以镁着火时不能用CO2灭火器进行灭火,故A错误;
B.NO2和Br2蒸气均能氧化KI中的碘离子生成碘单质,遇淀粉变蓝,现象相同,不能鉴别,故B错误;
C.氮气分子内部存在氮氮三键,键能很高,氮气化学性质稳定,一般不会和其他物质间发生反应,故C正确;
D.NO为无色气体,故D错误.
故选C.
点评 本题考查元素及其化合物的性质,熟悉NO气体的物理性质和化学性质是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
15.T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(1)所示,若保持其他条件不变,温度分别为T1℃和T2℃时,B的体积分数与时间的关系如图(2)所示,则下列结论正确的是( )
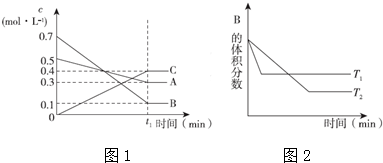

| A. | 该平衡体系的化学反应方程式为:3A(g)+B(g)═4 C(g) | |
| B. | 在t1时间内用B表示该反应的平均速率为0.6/t1mol•L-1•min-1 | |
| C. | 其他条件不变,升高温度,正反应速率减小、逆反应速率增大,A的转化率减小 | |
| D. | 维持温度和容器体积不变,往平衡体系中充惰性气体,C的百分含量增大 |
16.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 22.4L氯气与足量的钠反应,转移的电子数为2NA | |
| B. | 常温常压下,32gO3或O2中含有的氧原子数都为2NA | |
| C. | 1 mol氯气与足量水反应时,转移的电子数为2NA | |
| D. | 含2 mol H2SO4的浓硫酸与足量铜反应,转移的电子数为2NA |
13.下列说法中,正确的是( )
| A. | 化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中 | |
| B. | 人们可以利用化学变化制造出新的分子和原子 | |
| C. | 门捷列夫提出的原子学说,为现代化学的发展奠定了坚实的基础 | |
| D. | 化学科学在未来还将继续推动材料科学的发展,使各种新功能材料的生产成为可能 |
20.下列问题与NO2的排放无关的是( )
| A. | 酸雨 | B. | 温室效应 | ||
| C. | 光化学烟雾 | D. | 腐蚀金属和非金属材料 |
10.由一种阳离子与两种酸根离子组成的盐称为混盐.混盐Na4S2O3,在酸性条件下可以产生S.下列关于混盐
Na4S2O3的有关判断不正确的是( )
Na4S2O3的有关判断不正确的是( )
| A. | 该混盐的水溶液呈碱性 | |
| B. | 该混盐溶液中加人BaCl2溶液,可以生成白色沉淀 | |
| C. | 该混盐与稀硫酸反应产生1mol S时转移2NA个电子 | |
| D. | 该混盐中的硫元素的化合价为-2和+4 |
17.下列实验操作能达到预期实验目的是( )
| 实验目的 | 实验操作 |
| A.证明Fe3+与SO2发生了氧化还原反应 | 将过量SO2通入FeCl3溶液中,然后将反应液加入酸性高锰酸钾溶液中,发现高锰酸钾溶液褪色. |
| B.除去CH3COOC2H5中的乙醇 | 加入适量CH3COOH,加热 |
| C.鉴别等浓度的Na2CO3溶液和NaHCO3溶液 | 分别向未知的溶液中滴加同浓度的盐酸,观察 现象 |
| D.比较H2CO3、HCN的酸性强弱 | 用pH计测定同温度同浓度的Na2CO3溶液和NaCN溶液 的pH值,比较pH大小 |
| A. | A | B. | B | C. | C | D. | D |
14.下列变化中,既没有化学键断裂,也没有化学键形成的是( )
| A. | 氯化氢溶于水 | B. | 冰变成气态水 | C. | 生石灰溶于水 | D. | NaCl熔化 |