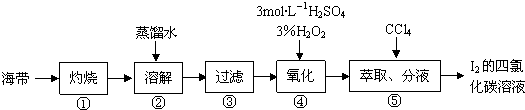
题目内容
在250mL某混合溶液中,HNO3和H2SO4物质的量浓度分别为0.2mol?L-1和0.1mol?L-1.向该混合溶液中加入1.92克铜粉,加热充分反应.
(1)写出该反应的离子方程式 .
(2)计算所得溶液中Cu2+的物质的量浓度.
(1)写出该反应的离子方程式
(2)计算所得溶液中Cu2+的物质的量浓度.
考点:化学方程式的有关计算
专题:计算题
分析:(1)铜与稀硝酸反应生成硝酸铜、NO、水,写出离子方程式;
(2)n(Cu)=
=0.03mol,n(H+)=0.2mol/L×0.25L+0.1mol/L×2×0.25L=0.1mol,n(NO3-)=0.2mol/L×0.25L=0.05mol,发生3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,判断过量后以不足量代入计算.
(2)n(Cu)=
| 1.92g |
| 64g/mol |
解答:
解:(1)铜与稀硝酸反应生成硝酸铜、NO、水,离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO+4H2O;
(2)n(Cu)=
=0.03mol,n(H+)=0.2mol/L×0.25L+0.1mol/L×2×0.25L=0.1mol,n(NO3-)=0.2mol/L×0.25L=0.05mol,
由 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3 8 2
0.03mol 0.08mol 0.02mol
显然铜单质不足,完全反应,生成铜离子0.03mol,
所以溶液中c(Cu2+)=
=0.12mol/L,
答:所得溶液中的Cu2+的物质的量浓度为0.12mol/L
故答案为:3Cu+8H++2NO3-=3Cu2++2NO+4H2O;
(2)n(Cu)=
| 1.92g |
| 64g/mol |
由 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3 8 2
0.03mol 0.08mol 0.02mol
显然铜单质不足,完全反应,生成铜离子0.03mol,
所以溶液中c(Cu2+)=
| 0.03mol |
| 0.25mol |
答:所得溶液中的Cu2+的物质的量浓度为0.12mol/L
点评:本题考查离子反应的计算,解答该题的关键是把握反应的离子方程式及判断反应的过量问题,侧重分析能力和计算能力的考查,题目难度中等.

练习册系列答案
相关题目
下列氯化物中,不能由金属和氯气直接参与化合制得是( )
| A、CuCl2 |
| B、FeCl2 |
| C、MgCl2 |
| D、FeCl3 |
 美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子(如图所示),就像一尊释迦牟尼佛.因而称为释迦牟尼分子(所有原子在同一平面).有关该有机分子的说法不正确的是( )
美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子(如图所示),就像一尊释迦牟尼佛.因而称为释迦牟尼分子(所有原子在同一平面).有关该有机分子的说法不正确的是( )| A、该有机物属于芳香烃 |
| B、该有机物属于苯的同系物 |
| C、该有机物分子中含有22个碳原子 |
| D、该有机物一氯代物只有6种 |
质量相等的两份铝粉,分别与足量的氢氧化钠溶液和稀盐酸反应,在同温同压下产生氢气的体积比为( )
| A、1:1 | B、1:2 |
| C、3:2 | D、1:3 |

 在沥青蒸气里含有多种稠环芳香烃,如图所示A、B、C …,
在沥青蒸气里含有多种稠环芳香烃,如图所示A、B、C …,