题目内容
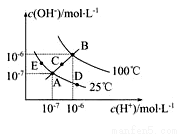
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe3+、Cl-、NO 、K+
、K+
B.滴入酚酞显红色的溶液中:Na+、Mg2+、AlO 、NO
、NO
C.加入铝粉产生H2的溶液中:Fe2+、Na+、SO 、ClO-
、ClO-
D.c(SO )=0.1 mol·L-1的溶液中:Na+、Cl-、H+、Ca2+
)=0.1 mol·L-1的溶液中:Na+、Cl-、H+、Ca2+
练习册系列答案
相关题目
3.短周期元素X、Y、Z、W、Q的原子序数依次增大,X与Q同主族,X的最外层电子数是次外层电子数的2倍,W的最外层电子数等于其电子层数,Y与Z的核外电子数之和等于X与Q的核外电子数之和,下列说法正确的是( )
| A. | Z、W、Q、X、Y原子半径依次减小 | |
| B. | W最高价氧化物对应水化物一定能溶于Z最高价氧化物对应水化物的溶液中 | |
| C. | Y与Q形成化合物在常温下一定为气态 | |
| D. | Z、Q元素的单质都可以将X元素的单质从其氧化物中置换出来 |
2. 向甲、乙、丙三个恒容密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).相关数据如表,反应过程中C的浓度随时间变化关系如图.下列说法正确的是( )
向甲、乙、丙三个恒容密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).相关数据如表,反应过程中C的浓度随时间变化关系如图.下列说法正确的是( )
 向甲、乙、丙三个恒容密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).相关数据如表,反应过程中C的浓度随时间变化关系如图.下列说法正确的是( )
向甲、乙、丙三个恒容密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).相关数据如表,反应过程中C的浓度随时间变化关系如图.下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6 mol A 2 mol B |
| A. | T1>T2,x=1 | |
| B. | T2℃时,该反应的平衡常数为0.8 | |
| C. | A的平衡转化率a(甲):a(乙)=2:3 | |
| D. | 15~20min内C的平均反应速率v(乙)<v(丙) |
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
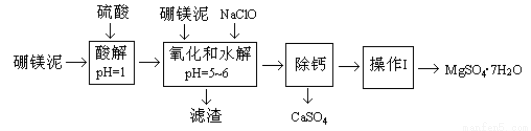
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有 。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式 。
在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法 。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 、 。