题目内容
下列离子方程式正确的( )
| A、向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-═BaSO4↓ |
| B、双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O |
| C、用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
考点:离子方程式的书写
专题:
分析:A.漏掉了氨根离子与氢氧根离子的反应;
B.双氧水具有氧化性,能够氧化碘离子生成单质碘;
C.醋酸为弱电解质,保留化学式;
D.电荷不守恒.
B.双氧水具有氧化性,能够氧化碘离子生成单质碘;
C.醋酸为弱电解质,保留化学式;
D.电荷不守恒.
解答:
解:A.向硫酸铵溶液中加入氢氧化钡溶液,离子方程式:2OH-+2NH4++Ba2++SO42-═BaSO4↓+2NH3?H2O,故A错误;
B.双氧水中加入稀硫酸和KI溶液,离子方程式:H2O2+2H++2I-═I2+2H2O,故B正确;
C.用CH3COOH溶解CaCO3,离子方程式:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故C错误;
D.Na2S2O3溶液中加入稀硫酸,离子方程式:S2O32-+2H+=SO2↑+S↓+H2O,故D错误;
故选:B.
B.双氧水中加入稀硫酸和KI溶液,离子方程式:H2O2+2H++2I-═I2+2H2O,故B正确;
C.用CH3COOH溶解CaCO3,离子方程式:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故C错误;
D.Na2S2O3溶液中加入稀硫酸,离子方程式:S2O32-+2H+=SO2↑+S↓+H2O,故D错误;
故选:B.
点评:本题考查了离子方程式的书写,明确反应的实质是解题关键,注意掌握离子方程式的书写原则,书写的离子方程式需要符合守恒关系,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
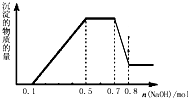 溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A、溶液中一定不含CO32-,可能含有SO42-和NO3- |
| B、在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:Al3++4OH-=AlO2-+2H2O |
| C、溶液中的阳离子只有H+、Mg2+、Al3+ |
| D、n(H+):n(NH4+):n(Mg2+)=2:4:1 |
影响化学反应速率的因素有多方面,如浓度.压强.温度.催化剂等.下列有关说法不正确的是( )
| A、改变压强能改变气体反应的速率 |
| B、增大浓度能加快化学反应速率,原因是增大浓度就增加了反应体系中活化分子的百分数 |
| C、温度升高使化学反应速率加快的主要原因是增加了反应体系中活化分子的百分数 |
| D、催化剂能加快化学反应速率主要原因是降低反应所需的能量 |
我们生活在千变万化的物质世界里.下列过程或变化中,没有发生氧化还原反应的是( )
| A、iPhone5手机电池充电 |
| B、铁制品镀铜 |
| C、爆竹爆炸 |
| D、利用焰色反应检验Na+ |
下列反应的离子方程式不正确的是( )
| A、铁与氯化铁溶液:2Fe3++Fe═3Fe2+ |
| B、氯气与溴化钠溶液:2Br-+Cl2═Br2+2Cl- |
| C、硫酸铵和氢氧化钡溶液:Ba2++SO42-═BaSO4↓ |
| D、铜与稀硝酸:3Cu+8H++2NO3-═Cu2++2NO↑+4H2O |
 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.