题目内容
下列现象与电化学腐蚀无关的是( )
| A、生铁比纯铁更易生锈 |
| B、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| C、银质奖章久置后易表面变暗 |
| D、海轮上一般会在吃水线下绑定一定量的锌块 |
考点:金属的电化学腐蚀与防护
专题:电化学专题
分析:A、生铁中含有碳、铁,易形成原电池;
B、铜锌合金构成的原电池中,锌是负极,易被腐蚀;
C、金属银在空气中会和硫化氢发生反应;
D、金属铁、锌构成的原电池中,金属锌是负极,铁是正极,正极金属被保护.
B、铜锌合金构成的原电池中,锌是负极,易被腐蚀;
C、金属银在空气中会和硫化氢发生反应;
D、金属铁、锌构成的原电池中,金属锌是负极,铁是正极,正极金属被保护.
解答:
解:A、生铁中含有碳、铁,易形成原电池,发生电化学腐蚀,但是纯铁不易被腐蚀,与电化学腐蚀有关,故A错误;
B、铜锌合金构成的原电池中,锌是负极,易被腐蚀,铜是正极,被保护,铜锣不易产生铜绿,与电化学腐蚀有关,故B错误;
C、金属银在空气中会被氧化而变暗,发生的是化学腐蚀,与电化学腐蚀无关,故C正确;
D、金属铁、锌构成的原电池中,金属锌是负极,铁是正极,正极金属铁被保护,与电化学腐蚀有关,故D错误.
故选C.
B、铜锌合金构成的原电池中,锌是负极,易被腐蚀,铜是正极,被保护,铜锣不易产生铜绿,与电化学腐蚀有关,故B错误;
C、金属银在空气中会被氧化而变暗,发生的是化学腐蚀,与电化学腐蚀无关,故C正确;
D、金属铁、锌构成的原电池中,金属锌是负极,铁是正极,正极金属铁被保护,与电化学腐蚀有关,故D错误.
故选C.
点评:本题考查学生金属腐蚀的类型以及原电池的工作原理的应用知识,注意金属的腐蚀和防护知识的应用,难度中等.

练习册系列答案
相关题目
常见的一种锂离子电池的工作原理为LiCoO2+6C
Li1-xCoO2+LixC6.下列说法正确的是( )
| 充电 |
| 放电 |
| A、充电时,阳极的电极反应式为Li1-xCoO2+xLi+xe-═LiCoO2 |
| B、充电时锂离子由阴极流向阳极 |
| C、放电时,负极的电极反应式为6C+xLi++xe-═Li2C6 |
| D、放电时锂离子由负极流向正极 |
关于下列各装置图的叙述中,正确的是( )
A、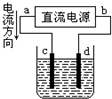 d极发生氧化反应、c极发生还原反应 |
B、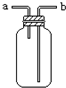 从a口通入气体,可用于收集H2、NH3、NO等气体 |
C、 X若为CCl4,上层为稀硫酸,可用于吸收氨气,并防止倒吸 |
D、 可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
0.5mol氧气的质量是( )
| A、8g | B、16g |
| C、24g | D、32g |
已知:电离平衡常数:H2SO3>H2CO3>HClO>HCO3- (25℃),氧化性:KMnO4>Cl2>Br2>Fe3+.下列离子方程式正确的是( )
| A、FeBr2溶液中滴加少量氯水:2Br-+Cl2═Br2+2Cl- |
| B、NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- |
| C、浓盐酸中加入KMnO4:2KMnO4-+10Cl-+16H+═2Mn2++5Cl2↑+8H2O |
| D、足量SO2通入NaHCO3溶液中:2HCO3-+SO2═SO32-+2CO2+H2O |
下列有关实验装置图及描述均正确的是( )
A、 制取Fe(OH)2 |
B、 碳酸氢钠受热分解 |
C、 向容器瓶中转移溶液 |
D、 中和热的测定 |
向明矾溶液中逐渐滴加Ba(OH)2溶液,符合要求的离子方程式为( )
| A、加入过量的Ba(OH)2溶液时:2Al3++3SO42-+3Ba2++6OH-→2Al(OH)3↓+3BaSO4↓ |
| B、溶液恰好呈中性时:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| C、SO42-离子恰好完全沉淀时:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D、明矾与Ba(OH)2按物质的量比1:1反应时:Al3++SO42-+Ba2++3OH-→Al(OH)3↓+BaSO4↓ |
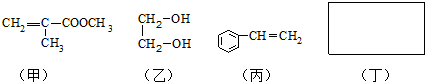
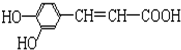
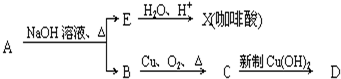
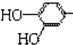 结构;②能发生水解反应;R的结构简式为
结构;②能发生水解反应;R的结构简式为