题目内容
11.一定条件下,在体积为5L的密闭容器中,0.5mol X和0.5mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.15mol Z,下列说法正确的是( )| A. | 平衡后充入氦气,平衡正向移动 | |
| B. | 以X浓度变化表示反应速率:v(X)=0.001 mol/(L•s) | |
| C. | 平衡后升高温度Y的转化率减小,则正反应为吸热反应 | |
| D. | 达到平衡时,X与Y 的浓度相等 |
分析 A、平衡后充入氦气,体积不变,各组分浓度不变;
B、一定条件下,体积为5L的密闭容器中,0.5molX和0.5molY进行反应,经60s达到平衡,生成0.15molZ,依据平衡三段式列式计算;
2X(g)+Y(g)?Z(g)
起始量(mol) 0.5 0.5 0
变化量(mol) 0.3 0.15 0.15
平衡量(mol)0.2 0.35 0.15
据此分析计算判断;
C、平衡后升高温度Y的转化率减小,即反应逆向进行,升高温度,平衡向着吸热方向进行;
D、达到平衡时,各组分的浓度不会发生变化.
解答 解:A、平衡后充入氦气,体积不变,各组分浓度不变,所以平衡不会发生移动,故A错误;
B、一定条件下,体积为5L的密闭容器中,0.5molX和0.5molY进行反应,经60s达到平衡,生成0.15molZ,依据平衡三段式列式计算;
2X(g)+Y(g)?Z(g)
起始量(mol) 0.5 0.5 0
变化量(mol) 0.3 0.15 0.15
平衡量(mol) 0.2 0.35 0.15
以X浓度变化表示反应速率:v(X)=$\frac{\frac{0.3mol}{5L}}{60s}$=0.001 mol/(L•s),故B正确;
C、平衡后升高温度Y的转化率减小,即反应逆向进行,升高温度,平衡向着吸热方向进行,所以逆向是吸热的方向,则正反应为放热反应,故C错误;
D、根据B中数据,达到平衡时,各组分的浓度不会发生变化,X与Y的浓度之比是4:7,故D错误.
故选B.
点评 本题考查了化学平衡的计算应用,化学平衡移动原理的分析判断,掌握平衡影响因素是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列叙述正确的是( )
| A. | 共价化合物中可能有离子键 | |
| B. | 非金属原子间不可能形成离子化合物 | |
| C. | 离子化合物中可能有共价键 | |
| D. | 两个非金属原子间可能形成离子键 |
6.在酸性溶液中,可大量共存且形成无色溶液的是( )
| A. | Ba2+、NO3-、Cl-、Na+ | B. | NO3-、Fe3+、Mg2+、SO42- | ||
| C. | Ca2+、Na+、Cl-、SO42- | D. | K+、Cl-、Al3+、OH- |
16.有A、B、C、D、E五种前四周期元素,其元素特征信息如表:
回答下列问题:
(1)元素C在周期表中的位置为第3周期ⅠA族.
(2)B基态原子的核外电子排布图 ;E基态原子的电子排布式1s22s22p63s23p63d54s1.
;E基态原子的电子排布式1s22s22p63s23p63d54s1.
(3)写出化合物A2B2的电子式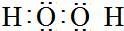 .
.
(4)D的氢氧化物与化合物CBA反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(5)B与C(碳)、N(氮)相比,第一电离能由大到小的顺序为N>O>C.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,电离能(I)数据依次为:I1=490kJ/mol-1,I2=4562kJ/mol-1,I3=6912kJ/mol-1… |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 在第四周期元素原子中,其所含不成对电子数最多 |
(1)元素C在周期表中的位置为第3周期ⅠA族.
(2)B基态原子的核外电子排布图
 ;E基态原子的电子排布式1s22s22p63s23p63d54s1.
;E基态原子的电子排布式1s22s22p63s23p63d54s1.(3)写出化合物A2B2的电子式
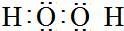 .
.(4)D的氢氧化物与化合物CBA反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(5)B与C(碳)、N(氮)相比,第一电离能由大到小的顺序为N>O>C.


 .
. .F1的结构简式是
.F1的结构简式是 .
.