题目内容
15.NO、NO2、NH3、SO2、CO等都是空气污染物.(1)酸雨的形成主要是大气中的NO2、SO2溶于水后形成了酸性溶液.
(2)在汽车的排气管上装一个催化转化装置,可使汽车尾气中的NO与CO反应,生成氮气和碳的另一种无污染的气体,请完成该转化的化学方程式:NO+CO--N2+CO2.
分析 (1)酸雨的形成主要是硫酸型酸雨和硝酸型酸雨,硫酸型酸雨是二氧化硫被氧化为三氧化硫,溶于水生成硫酸,硝酸型酸雨是氮氧化物溶于水生成硝酸,二氧化氮和水反应生成硝酸和一氧化氮,二氧化硫、氮氧化物溶于水能生成显酸性的物质,是形成酸雨的主要物质;
(2)依据NO和CO反应后的原子守恒分析产物,生成氮气和碳的另一种无污染的气体为CO2;
解答 解:(1)NO、NO2、NH3、SO2、CO等都是空气污染物,其中SO2溶于水和水反应生成亚硫酸,SO2+H2O=H2SO3,2H2SO3+O2=2H2SO4,二氧化硫溶于水后形成了酸性溶液,NO2溶于水生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,溶于水生成酸性溶液,NO、CO不溶于水,NH3极易溶于水生成碱性溶液,
故答案为:NO2、SO2;
(2)在汽车的排气管上装一个催化转化装置,可使汽车尾气中的NO与CO反应,生成氮气和碳的另一种无污染的气体为CO2,反应为NO+CO$\frac{\underline{\;催化剂\;}}{\;}$N2+CO2,
故答案为:CO2.
点评 本题考查了酸雨的形成原因,尾气处理方法,题目难度不大,明确酸雨的成因、危害及治理方法为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
11.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 将1molCH3COONa溶于水,向其中加入醋酸至溶液pH=7,此溶液中CH3COO-的数目约为6.02×1023 | |
| B. | pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-CH3COONa溶液与0.1mol•L-HCl溶液等体积混合:c(CH3COOH)>c(Cl-)>c(CH3COO-)>c(OH-) | |
| D. | 10mL0.1mol•L-1醋酸溶液与20mL0.1mol•L-NaOH溶液混合:c(OH-)=c(CH3COO-)+c(H+)+2c(CH3COOH) |
6.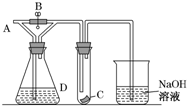 如图所示,A处通入干燥Cl2,关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是( )
如图所示,A处通入干燥Cl2,关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是( )
 如图所示,A处通入干燥Cl2,关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是( )
如图所示,A处通入干燥Cl2,关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是( )| A. | 浓H2SO4 | B. | NaOH溶液 | C. | 浓盐酸 | D. | 饱和NaCl溶液 |
3.在恒容的密闭容器中,下列能够判断可逆反应2A(g)+3B(g)?4C(g)+D(g) 已达到化学平衡状态的是( )
| A. | 单位时间内生成3n molB,同时消耗4n molC | |
| B. | 容器内压强不随时间变化 | |
| C. | 混合气体的密度不随时间变化 | |
| D. | B物质的百分含量不变 |
10.下列气体有颜色并有刺激性气味的是( )
| A. | CO | B. | Cl2 | C. | N2 | D. | CO2 |
20.下列关于Na的叙述中,不正确的是( )
| A. | Na原子最外层有1个电子,易失去,是活泼的金属元素 | |
| B. | Na原子失去1个电子,Al原子能失去3个电子,说明Na的还原性比Al弱 | |
| C. | Na与氧气反应,在不同的条件下生成不同的产物 | |
| D. | Na在空气中会发生变化,要保存在煤油中,以隔绝空气 |
4.利用右图所示装置进行下列实验,试管②中一定观察不到的现象是( )
| 选项 | a | b | c | 试管②中现象 | 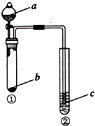 |
| A | NaOH溶液 | 铝 | 肥皂水 | 肥皂泡可点燃 | |
| B | 浓硫酸 | Na2SO3 | Na2SiO3溶液 | 生成白色胶状沉淀 | |
| C | 浓硫酸 | 铜 | 品红溶液 | 溶液红色褪去 | |
| D | 水 | Na2O2 | 酸化的KI溶液 | 溶液变黄 |
| A. | A | B. | B | C. | C | D. | D |
5.下列分子中既含有极性键又含有非极性键的非极性分子是( )
| A. | CH4 | B. | P4 | C. | H2O2 | D. | C2H2 |
