题目内容
下列叙述不正确的是( )
| A、原电池是将化学能转化为电能的装置 |
| B、铁船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| C、钢铁腐蚀的正极反应:Fe→Fe3++3e- |
| D、用惰性电极电解CuSO4溶液一段时间后,向其中加入CuO固体可以使溶液恢复到原来的浓度 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、原电池中发生氧化还原反应向外提供电能;
B、Zn、Fe构成原电池时,Fe作正极;
C、钢铁腐蚀时,Fe作负极失电子;
D、根据电解时两极上的产物判断.
B、Zn、Fe构成原电池时,Fe作正极;
C、钢铁腐蚀时,Fe作负极失电子;
D、根据电解时两极上的产物判断.
解答:
解:A、原电池中发生氧化还原反应向外提供电能,即原电池是将化学能转化为电能的装置,故A正确;
B、Zn、Fe构成原电池时,Fe作正极被保护,Zn作负极被腐蚀,故B正确;
C、钢铁腐蚀时,Fe作负极失电子,负极反应为Fe→Fe2++2e-,故C错误;
D、用惰性电极电解CuSO4溶液时,阴极生成Cu,阳极生成氧气,则电解一段时间后,向其中加入CuO固体可以使溶液恢复到原来的浓度,故D正确.
故选C.
B、Zn、Fe构成原电池时,Fe作正极被保护,Zn作负极被腐蚀,故B正确;
C、钢铁腐蚀时,Fe作负极失电子,负极反应为Fe→Fe2++2e-,故C错误;
D、用惰性电极电解CuSO4溶液时,阴极生成Cu,阳极生成氧气,则电解一段时间后,向其中加入CuO固体可以使溶液恢复到原来的浓度,故D正确.
故选C.
点评:本题考查了原电池原理和电解池原理的应用,注意把握金属的电化学腐蚀和防护原理,题目难度不大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
下列烯烃和HBr发生加成反应,所得的产物有同分异构体的是( )
| A、CH2=CH2 |
| B、CH3CH=CHCH3 |
| C、CH3CH=CH2 |
| D、CH3CH2CH=CHCH2CH3 |
下列装置或操作能达到实验目的是( )
A、 除去乙醇中的乙酸 |
B、 形成原电池 |
C、 铝热反应 |
D、 石油的蒸馏 |
 向MgCl2和AlCl3的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )
向MgCl2和AlCl3的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )| A、b、c两点沉淀物成分相同,d、e两点沉淀物成分相同 |
| B、在反应过程中,各状态点溶液的pH大小顺序是:e>d>c>a>b |
| C、b-c段与c-d段溶液中阴离子的物质的量相等 |
| D、在d点,向溶液中逐滴加入盐酸,沉淀量将减少 |
将Na2O2投入到FeCl2溶液中可观察到的现象是( )
| A、生成白色沉淀 |
| B、生成红褐色沉淀 |
| C、溶液变为棕黄色 |
| D、无气体生成 |
除去镁粉中含有的杂质铝粉可选用的溶液是( )
| A、硫酸 | B、氢氧化钠 |
| C、氨水 | D、氯化铜 |
下列说法正确的是( )
| A、含有金属阳离子的晶体一定是离子晶体 |
| B、固态和熔融状态可导电,投入水中形成的水溶液也可导电,该物质可能是金属晶体 |
| C、白磷晶体中只存在一种作用力,即分子间作用力 |
D、如图,NaCl晶体中,距离最近的Na+组成的最小多面体是正八面体 |
已知NH3极易溶于水,下列组合中不能形成喷泉的是( )
| A、HCl和H2O |
| B、O2和H2O |
| C、NH3和H2O |
| D、CO2和NaOH |
下列说法正确的是( )
| A、丙烷是直链烃,所以分子中3个碳原子也在一条直线上 |
| B、丙烯所有原子均在同一平面上 |
C、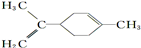 所有碳原子一定在同一平面上 所有碳原子一定在同一平面上 |
D、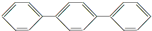 至少有16个原子共平面 至少有16个原子共平面 |