题目内容
4.以铝土矿为原料,提取氧化铝、冶炼铝的工艺流程如下
下列说法不正确的是( )
| A. | 试剂A可以是稀硫酸或盐酸 | |
| B. | 加入试剂B除去Mg2+、Fe3+ | |
| C. | 滤渣1的主要成分是SiO2 | |
| D. | 电解氧化铝时在阴极上定期补充炭块 |
分析 由流程可知试剂A的目的是将铝土矿中的金属氧化物溶解,因此试剂A可以是稀硫酸或稀盐酸,滤渣1为二氧化硅,过滤后加入试剂B为NaOH,可除去溶液中的Mg2+、Fe3+,滤渣2为氢氧化镁、氢氧化铁等,滤液中含有NaAlO2,可通入二氧化碳气体,生成氢氧化铝沉淀,经过滤、洗涤、灼烧得到氧化铝,电解熔融的氧化铝,得到铝,以此解答该题.
解答 解:A.由流程可知试剂A的目的是将铝土矿中的金属氧化物溶解,因此试剂A可以是稀硫酸或稀盐酸,故A正确;
B.加入盐酸后溶液中含有Mg2+、Fe3+,过滤后加入试剂B为NaOH,可除去溶液中的Mg2+、Fe3+,故B正确;
C.由以上分析可知滤渣I的主要成分是SiO2,故C正确;
D.电解氧化铝时阳极生成氧气,与碳反应生成二氧化碳,应在阳极定期补充炭块,故D错误.
故选D.
点评 本题以铁、铝化合物的性质为载体综合考查工业冶炼铝等知识,侧重于考查学生分析和解决问题的能力,综合性强,为高考常见题型,注意把握制备原理和反应的流程,难度中等.

练习册系列答案
相关题目
14.钴(Co)及其化合物在工业上有广泛应用,为从某工业废料中回收钴,设计了如下流程(废料中含有Al、Li、Co2O3和Fe2O3等物质).
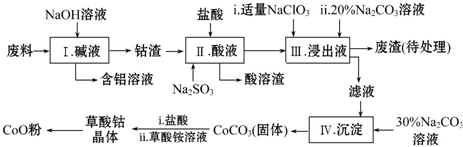
已知:部分金属离子形成氢氧化物沉淀的pH见下表:
请回答:
(1)步骤Ⅰ中得到含铝溶液的溶质是NaAlO2.
(2)写出步骤Ⅱ中Co2O3与Na2SO3反应的离子方程式是Co2O3+SO32-+4H+=Co2++SO42-+2H2O.
(3)步骤Ⅲ中若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,则该有毒气体是Cl2,其中,Na2CO3溶液的作用是调节溶液PH使铁离子沉淀完全转化为Fe(OH)3.
(4)在空气中加热草酸钴晶体(CoC2O4•2H2O)样品需要用到的主要仪器是坩埚,5.49g该晶体受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是3CoC2O4+2O2 $\frac{\underline{\;210℃-290℃\;}}{\;}$Co3O4+6CO2.[M(CoC2O4•2H2O)=183g•mol-1]
(5)从反应后的混合物中得到草酸钴晶体,需对晶体进行洗涤,洗涤的方法是在漏斗中加水没过沉淀,让水自行留下,重复2~3次.

已知:部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 5.2 |
(1)步骤Ⅰ中得到含铝溶液的溶质是NaAlO2.
(2)写出步骤Ⅱ中Co2O3与Na2SO3反应的离子方程式是Co2O3+SO32-+4H+=Co2++SO42-+2H2O.
(3)步骤Ⅲ中若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,则该有毒气体是Cl2,其中,Na2CO3溶液的作用是调节溶液PH使铁离子沉淀完全转化为Fe(OH)3.
(4)在空气中加热草酸钴晶体(CoC2O4•2H2O)样品需要用到的主要仪器是坩埚,5.49g该晶体受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
(5)从反应后的混合物中得到草酸钴晶体,需对晶体进行洗涤,洗涤的方法是在漏斗中加水没过沉淀,让水自行留下,重复2~3次.
15.有下列六种转化途径,某些反应条件和产物已省略,下列有关说法正确的是( )
途径①Fe$\stackrel{稀HCl}{→}$FeCl2溶液
途径②Fe $\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{Fe、水}{→}$FeCl2溶液
途径③Cl2$\stackrel{Na_{2}SO_{3}溶液}{→}$Na2SO4溶液
途径④Cl2$\stackrel{NaOH溶液}{→}$NaClO溶液$\stackrel{Na_{2}SO_{3}溶液}{→}$Na2SO4 溶液
途径⑤S$\stackrel{浓HNO_{3}}{→}$H2SO4
途径⑥S$\stackrel{O_{2}}{→}$SO2$\stackrel{O_{2}}{→}$SO3 $\stackrel{H_{2}O}{→}$H2SO4.
途径①Fe$\stackrel{稀HCl}{→}$FeCl2溶液
途径②Fe $\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{Fe、水}{→}$FeCl2溶液
途径③Cl2$\stackrel{Na_{2}SO_{3}溶液}{→}$Na2SO4溶液
途径④Cl2$\stackrel{NaOH溶液}{→}$NaClO溶液$\stackrel{Na_{2}SO_{3}溶液}{→}$Na2SO4 溶液
途径⑤S$\stackrel{浓HNO_{3}}{→}$H2SO4
途径⑥S$\stackrel{O_{2}}{→}$SO2$\stackrel{O_{2}}{→}$SO3 $\stackrel{H_{2}O}{→}$H2SO4.
| A. | 由途径①和②分别制取1molFeCl2,理论上各消耗1molFe,各转移2mole- | |
| B. | 由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 mol Cl2,各转移2mol e- | |
| C. | 由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1mol S,各转移6mol e- | |
| D. | 以上说法都不正确 |
12.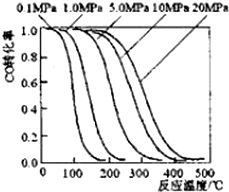 甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 $?_{高温高压}^{催化剂}$ CH3OH,工艺中一些参数如图;目前正在开发的新法2CH4+O2$?_{高温高压}^{催化剂}$2CH3OH,下列有关新法和旧法的说法正确的是( )
甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 $?_{高温高压}^{催化剂}$ CH3OH,工艺中一些参数如图;目前正在开发的新法2CH4+O2$?_{高温高压}^{催化剂}$2CH3OH,下列有关新法和旧法的说法正确的是( )
 甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 $?_{高温高压}^{催化剂}$ CH3OH,工艺中一些参数如图;目前正在开发的新法2CH4+O2$?_{高温高压}^{催化剂}$2CH3OH,下列有关新法和旧法的说法正确的是( )
甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 $?_{高温高压}^{催化剂}$ CH3OH,工艺中一些参数如图;目前正在开发的新法2CH4+O2$?_{高温高压}^{催化剂}$2CH3OH,下列有关新法和旧法的说法正确的是( )| A. | 旧法生产中,由图知CO与H2合成甲醇的反应属于放热反应 | |
| B. | 旧法生产中,选择合适的催化剂时,可推测高压法合成比低压法合成更有发展优势 | |
| C. | 新法与旧法相比,反应更困难 | |
| D. | 新法生产中,需控制V(CH4)/V(O2)=9:1,目的是提高空气中氧气的转化率 |
19.关于一氧化碳和氢气,下列叙述不正确的是( )
| A. | 都具有可燃性 | |
| B. | 通常状况下都是没有颜色、没有气味的气体 | |
| C. | 都具有还原性 | |
| D. | 都有剧毒 |
9.两个体积相同的容器,一个盛CO2,另一个盛N2和O2,在同温同压下,两容器内的气体一定具有相同的( )
| A. | 原子总数 | B. | 摩尔质量 | C. | 分子总数 | D. | 质量 |
13.下列物质中,属于电解质且能导电的是( )
| A. | 石墨 | B. | 硫酸溶液 | C. | 熔融氯化钠 | D. | 固态氯化钾 |
