题目内容
下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)11种元素中,化学性质最不活泼的是 .
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是 .
(3)元素⑦的氢化物分子式为 ,该氢化物常温下和元素②的单质反应的离子方程式是 ,
(4)①和⑨两元素形成化合物的化学式为 ,该化合物灼烧时焰色为 ,
(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为 .
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ⑾ | |||||
| 三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 四 | ② | ④ | ⑨ |
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是
(3)元素⑦的氢化物分子式为
(4)①和⑨两元素形成化合物的化学式为
(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar、⑾为F,
(1)稀有气体化学性质最不活泼;
(2)同周期自左而右非金属性减弱,同主族自上而下金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强;
(3)元素⑦的氢化物为水,常温下与K与水反应生成KOH与氢气;
(4)根据化合价书写化学式,Na元素焰色反应为黄色;
(5)氢氧化铝与氢氧化钠反应生成偏铝酸钠与水.
(1)稀有气体化学性质最不活泼;
(2)同周期自左而右非金属性减弱,同主族自上而下金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强;
(3)元素⑦的氢化物为水,常温下与K与水反应生成KOH与氢气;
(4)根据化合价书写化学式,Na元素焰色反应为黄色;
(5)氢氧化铝与氢氧化钠反应生成偏铝酸钠与水.
解答:
解:由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar、⑾为F,
(1)稀有气体最外层为稳定结构,故Ar化学性质最不活泼,故答案为:Ar;
(2)同周期自左而右非金属性减弱,同主族自上而下金属性增强,故金属性K>Na>Al,金属性越强,最高价氧化物对应水化物的碱性越强,则KOH的碱性最强,故答案为:KOH;
(3)元素⑦为O,氢化物为H2O,常温下与K与水反应生成KOH与氢气,反应方程式为:2K+H2O=2K++2OH-+H2↑,故答案为:H2O;2K+H2O=2K++2OH-+H2↑;
(4)Na与Br两元素形成化合物为NaBr,含有Na元素,灼烧时焰色为黄色,故答案为:NaBr;黄色;
(5)氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:Al(OH)3+NaOH═NaAlO2+2H2O,故答案为:Al(OH)3+NaOH═NaAlO2+2H2O.
(1)稀有气体最外层为稳定结构,故Ar化学性质最不活泼,故答案为:Ar;
(2)同周期自左而右非金属性减弱,同主族自上而下金属性增强,故金属性K>Na>Al,金属性越强,最高价氧化物对应水化物的碱性越强,则KOH的碱性最强,故答案为:KOH;
(3)元素⑦为O,氢化物为H2O,常温下与K与水反应生成KOH与氢气,反应方程式为:2K+H2O=2K++2OH-+H2↑,故答案为:H2O;2K+H2O=2K++2OH-+H2↑;
(4)Na与Br两元素形成化合物为NaBr,含有Na元素,灼烧时焰色为黄色,故答案为:NaBr;黄色;
(5)氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:Al(OH)3+NaOH═NaAlO2+2H2O,故答案为:Al(OH)3+NaOH═NaAlO2+2H2O.
点评:本题考查元素周期表与元素周期律,难度不大,注意整体把握元素周期律的结构,侧重对基础知识的巩固.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
已知断开1mol H-H键吸收的能量为436kJ,断开1mol H-N键吸收的能量为391kJ,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,则断开1mol N≡N键吸收的能量是( )
| A、431 kJ |
| B、945.6 kJ |
| C、649 kJ |
| D、869 kJ |
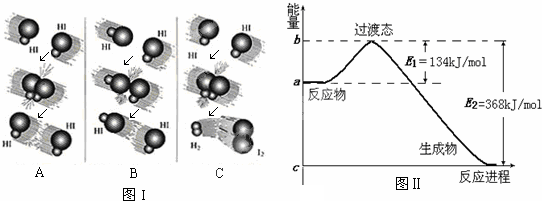
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-98.32kJ?mol-1
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-98.32kJ?mol-1