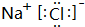题目内容
11.某实验小组同学进行如下实验,以检验化学反应中的能量变化.请回答下列问题: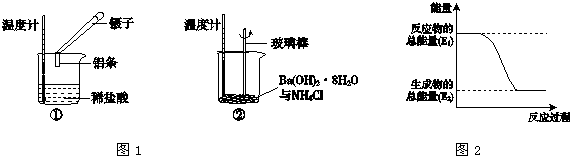
(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是放热反应,Ba(OH)2•8H2O与NH4Cl的反应是吸 热反应.反应过程① (填“①”或“②”)的能量变化可用图2表示.
(2)现有如下两个反应:
(A)NaOH+HCl=NaCl+H2O (B)2FeCl3+Cu=2FeCl2+CuCl2
以上两个反应能设计成原电池的是B,负极材料为:Cu,电解质溶液为:FeCl3,负极的电极反应式为:Cu-2e-═Cu2+.
分析 (1)化学反应中,温度升高,则反应放热;温度降低则反应吸热;图2中反应物总能量大于生成物总能量,该反应为放热反应,据此进行解答;
(2)自发进行的放热的氧化还原反应能设计成原电池;该原电池中,失电子的金属单质作负极,不如Cu活泼的金属或导电的非金属性作正极,电解质溶液为可溶性的氯化铁溶液,负极上Cu失电子发生氧化反应、正极上铜离子得电子发生还原反应.
解答 解:(1)Al与HCl反应后,温度升高,则说明反应放热,Ba(OH)2•8H2O与NH4Cl的反应温度降低,说明反应为吸热反应;
反应①为放热反应,反应物的总能量大于生成物的总能量,所以①的能量变化可用图2表示;故答案为:放;吸;①;
(2)自发进行的放热的氧化还原反应能设计成原电池,A反应中没有电子转移,不属于氧化还原反应,所以不能设计成原电池;B属于自发进行的放热的氧化还原反应,所以能设计成原电池,该原电池中,Cu失电子作负极,不如Cu活泼的金属或导电的非金属性作正极,电解质溶液为可溶性的氯化铁溶液,正极上铜离子得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+,负极上Cu失电子发生氧化反应,电极反应式为:Cu-2e-═Cu2+;
故答案为:B;Cu;FeCl3溶液;Cu-2e-═Cu2+.
点评 本题考查根据实验现象判断放热与吸热反应,原电池设计,难度不大,侧重于基础知识的考查,注意把握实验原理.

练习册系列答案
相关题目
2.下列说法错误的是( )
| A. | 键能越大,键长越短,分子越稳定 | |
| B. | 同主族元素从上到下第一电离能减小 | |
| C. | 同周期主族元素从左到右,第一电离能都不断增大 | |
| D. | 共价键都有饱和性,但不一定都有方向性 |
6.你认为下列行为不符合“善待地球-珍惜资源、持续发展”这一主题的是( )
| A. | 开发太阳能等新能源,减少使用煤、石油等化石燃料 | |
| B. | 推广使用乙醇汽油,尽量减少污染 | |
| C. | 研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用,即减少资源消耗、增加资源的重复使用及资源的循环再生 |
16.下列反应属于吸热反应的是( )
| A. | 锌粒与稀硫酸的反应 | |
| B. | 木炭燃烧 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
20.下列反应中,属于吸热反应的是( )
| A. | 钠与水反应 | B. | 铝与稀盐酸反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 甲烷与O2的燃烧反应 |
1.简单原子的原子结构可用下图的表示方法形象表示,其中●表示质子或电子,○表示中子,则有关①②③的叙述正确的是( )

| A. | ①②③是化学性质不同的粒子 | B. | ①不是核素,②③才是核素 | ||
| C. | ①②③具有相同的质量数 | D. | ①②③互为同位素 |


 )是制备氯丁橡胶的原料,它只比1,3-丁二烯(
)是制备氯丁橡胶的原料,它只比1,3-丁二烯( )多一个氯原子.但由于双键上的氢原子很难发生取代反应,不能通过1,3-丁二烯直接与氯气反应制得.2-氯-1,3-丁二烯的逆合成分析为:
)多一个氯原子.但由于双键上的氢原子很难发生取代反应,不能通过1,3-丁二烯直接与氯气反应制得.2-氯-1,3-丁二烯的逆合成分析为: $\stackrel{②}{→}$
$\stackrel{②}{→}$ $\stackrel{③}{→}$
$\stackrel{③}{→}$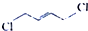 $\stackrel{④}{→}$
$\stackrel{④}{→}$ (提示:可利用1,3-丁二烯与Cl2的1,4-加成反应)
(提示:可利用1,3-丁二烯与Cl2的1,4-加成反应)