题目内容
下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
(1)C的原子结构示意图为
(2)A与G形成的化合物X的结构式为 ,其中X中含有的化学键是 ,X属于 化合物(填“离子”或“共价”).
(3)比较非金属性强弱G H(填“>”或“<”).
(4)在一定条件下,A与E可形成一种化合物Y,其相对分子质量与O2相同,则Y为 ; Y可在纯氧中燃烧,所得产物无污染,涉及的化学方程式为
(5)“神舟”六号载人飞船内需要用化合物Z(由上表中的某2种元素组成)来吸收航天员呼出的CO2,请用化学方程式表示吸收原理
(6)E的气态氢化物与其最高价氧化物水化物反应的产物W在一定温度下分解,生成两种氧化物,每1mol W分解时转移的电子为4mol,W受热分解的化学方程式为 .
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
(2)A与G形成的化合物X的结构式为
(3)比较非金属性强弱G
(4)在一定条件下,A与E可形成一种化合物Y,其相对分子质量与O2相同,则Y为
(5)“神舟”六号载人飞船内需要用化合物Z(由上表中的某2种元素组成)来吸收航天员呼出的CO2,请用化学方程式表示吸收原理
(6)E的气态氢化物与其最高价氧化物水化物反应的产物W在一定温度下分解,生成两种氧化物,每1mol W分解时转移的电子为4mol,W受热分解的化学方程式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知A为氢、B为He、C为Na、D为碳、E为氮、F为氧、G为硫、H为Cl.
(1)Na元素原子核外有11个电子,有3个电子层,各层电子数为2、8、1;
(2)A与G形成的化合物X为H2S,分子中S原子与H原子之间形成1对共用电子对,属于共价化合物,含有化学键为极性键;
(3)同周期自左而右元素的非金属性增强;
(4)在一定条件下,氢元素与氮元素可形成一种化合物Y,其相对分子质量与O2相同,则Y为 N2H4,在纯氧中燃烧,所得产物无污染,应生成氮气与水;
(5)过氧化钠与二氧化碳反应生成碳酸钠与氧气,可以吸收二氧化碳,提供氧气;
(6)氮元素的气态氢化物与其最高价氧化物水化物反应的产物W为NH4NO3,在一定温度下分解,生成两种氧化物,应生成氮的氧化物与水,每1mol W分解时转移的电子为4mol,令氧化物中N元素化合价为x,则1mol×(5-x)=4mol,故x=1,则生成N2O,电子转移守恒,符合题意.
(1)Na元素原子核外有11个电子,有3个电子层,各层电子数为2、8、1;
(2)A与G形成的化合物X为H2S,分子中S原子与H原子之间形成1对共用电子对,属于共价化合物,含有化学键为极性键;
(3)同周期自左而右元素的非金属性增强;
(4)在一定条件下,氢元素与氮元素可形成一种化合物Y,其相对分子质量与O2相同,则Y为 N2H4,在纯氧中燃烧,所得产物无污染,应生成氮气与水;
(5)过氧化钠与二氧化碳反应生成碳酸钠与氧气,可以吸收二氧化碳,提供氧气;
(6)氮元素的气态氢化物与其最高价氧化物水化物反应的产物W为NH4NO3,在一定温度下分解,生成两种氧化物,应生成氮的氧化物与水,每1mol W分解时转移的电子为4mol,令氧化物中N元素化合价为x,则1mol×(5-x)=4mol,故x=1,则生成N2O,电子转移守恒,符合题意.
解答:
解:由元素在周期表中位置,可知A为氢、B为He、C为Na、D为碳、E为氮、F为氧、G为硫、H为Cl.
(1)Na元素原子核外有11个电子,有3个电子层,各层电子数为2、8、1,原子结构示意图为: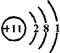 ,故答案为:
,故答案为: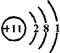 ;
;
(2)A与G形成的化合物X为H2S,分子中S原子与H原子之间形成1对共用电子对,结构式为H-S-H,含有化学键为极性键,属于共价化合物,故答案为:H-S-H;极性键;共价;
(3)同周期自左而右元素的非金属性增强,故非金属性S<Cl,故答案为:<;
(4)在一定条件下,氢元素与氮元素可形成一种化合物Y,其相对分子质量与O2相同,则Y为 N2H4,在纯氧中燃烧,所得产物无污染,应生成氮气与水,反应方程式为:N2H4+O2
N2+2H2O,
故答案为:N2H4;N2H4+O2
N2+2H2O;
(5)过氧化钠与二氧化碳反应生成碳酸钠与氧气,可以吸收二氧化碳,提供氧气,反应方式为:2CO2+2Na2O2=2Na2CO3+O2 ,
故答案为:2CO2+2Na2O2=2Na2CO3+O2 ;
(6)氮元素的气态氢化物与其最高价氧化物水化物反应的产物W为NH4NO3,在一定温度下分解,生成两种氧化物,应生成氮的氧化物与水,每1mol W分解时转移的电子为4mol,令氧化物中N元素化合价为x,则1mol×(5-x)=4mol,故x=1,则生成N2O,电子转移守恒,符合题意,受热分解的化学方程式为:NH4NO3
N2O↑+2H2O,故答案为:NH4NO3
N2O↑+2H2O.
(1)Na元素原子核外有11个电子,有3个电子层,各层电子数为2、8、1,原子结构示意图为:
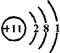 ,故答案为:
,故答案为: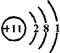 ;
;(2)A与G形成的化合物X为H2S,分子中S原子与H原子之间形成1对共用电子对,结构式为H-S-H,含有化学键为极性键,属于共价化合物,故答案为:H-S-H;极性键;共价;
(3)同周期自左而右元素的非金属性增强,故非金属性S<Cl,故答案为:<;
(4)在一定条件下,氢元素与氮元素可形成一种化合物Y,其相对分子质量与O2相同,则Y为 N2H4,在纯氧中燃烧,所得产物无污染,应生成氮气与水,反应方程式为:N2H4+O2
| ||
故答案为:N2H4;N2H4+O2
| ||
(5)过氧化钠与二氧化碳反应生成碳酸钠与氧气,可以吸收二氧化碳,提供氧气,反应方式为:2CO2+2Na2O2=2Na2CO3+O2 ,
故答案为:2CO2+2Na2O2=2Na2CO3+O2 ;
(6)氮元素的气态氢化物与其最高价氧化物水化物反应的产物W为NH4NO3,在一定温度下分解,生成两种氧化物,应生成氮的氧化物与水,每1mol W分解时转移的电子为4mol,令氧化物中N元素化合价为x,则1mol×(5-x)=4mol,故x=1,则生成N2O,电子转移守恒,符合题意,受热分解的化学方程式为:NH4NO3
| ||
| ||
点评:本题考查元素周期表和元素周期律的综合应用,侧重考查学生对物质结构、物质性质及元素周期律的掌握,熟练掌握基本概念、基本理论及物质结构即可解答,题目难度不大.

练习册系列答案
相关题目
下列有关说法正确的是( )
| A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B、当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 |
| C、CH3COOH溶液加水稀释后,电离平衡正向移动,溶液中的c(CH3COO-)增大 |
| D、Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
氢键既可以存在于分子之间,也可以存在于分子内部的原子团之间,如邻羟基苯甲醛分子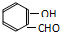 ) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子(
) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子( 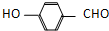 )之间存在氢键(分子间氢键).则两者的熔点、沸点的相对大小关系是( )
)之间存在氢键(分子间氢键).则两者的熔点、沸点的相对大小关系是( )
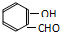 ) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子(
) 内的羟基与醛基之间即存在氢键(分子内氢键),对羟基苯甲醛分子(  )之间存在氢键(分子间氢键).则两者的熔点、沸点的相对大小关系是( )
)之间存在氢键(分子间氢键).则两者的熔点、沸点的相对大小关系是( )| A、前者>后者 | B、前者<后者 |
| C、前者=后者 | D、无法估计 |
有a、b、c、d四种主族元素,已知a、b的阳离子和c、d的阴离子都具有相同的电子层结构,而且原子半径a>b,阴离子所带的负电荷数为c>d.则四种元素核电荷数由小到大的顺序为( )
| A、d<c<a<b |
| B、c<d<b<a |
| C、d<a<b<c |
| D、c<d<a<b |
能正确表示下列反应的离子方程式是( )
| A、Ba(OH)2与稀H2SO4反应 Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B、饱和碳酸钠溶液中通入足量CO2 CO32-+H2O+CO2═2HCO3- |
| C、C12与NaOH溶液反应 Cl2+2OH-═C1-+C1O-+H2O |
| D、把金属铁放入稀硫酸中 2Fe+6H+═2Fe3++3H2↑ |