题目内容
6.已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法中正确的是( )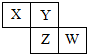
| A. | W的原子序数不可能是X的原子序数的3倍 | |
| B. | Z元素可能是金属元素 | |
| C. | W的气态氢化物的稳定性一定比Y的强 | |
| D. | 四种元素的原子有可能均能与氢原子形成18电子分子 |
分析 X、Y、Z、W四种短周期主族元素,根据元素在周期表中的相对位置知,X和Y位于第二周期、Z和W位于第三周期,如果W是Cl元素,则X、Y、Z分别是N、O、S元素;
如果W是S元素,则X、Y、Z分别是C、N、P元素;
如果W是P元素,则X、Y、Z分别是B、C、Si元素;
结合题目分析解答.
解答 解:X、Y、Z、W四种短周期主族元素,根据元素在周期表中的相对位置知,X和Y位于第二周期、Z和W位于第三周期,如果W是Cl元素,则X、Y、Z分别是N、O、S元素;
如果W是S元素,则X、Y、Z分别是C、N、P元素;
如果W是P元素,则X、Y、Z分别是B、C、Si元素;
A.如果W是P、X是B元素,则W原子序数是X的3倍,故A错误;
B.Z可能是P、Si元素,所以Z不可能为金属元素,故B错误;
C.N元素电负性大于S,则N元素氢化物稳定性大于S元素氢化物,故C错误;
D.若X、Y、Z、W分别是N、O、S、Cl元素,那么它们与H原子形成18电子的分子分别是N2H4、H2O2、H2S、HCl,故D正确;
故选D.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析判断及发散思维能力,明确周期表结构、原子结构及元素周期律是解本题关键,注意规律中的反常现象,采用举例法分析解答.

练习册系列答案
相关题目
16.化学与科学、技术、社会、环境密切相关.下列有关说法不正确的是( )
| A. | 聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子化合物 | |
| B. | 高纯度的二氧化硅广泛用于制作光导纤维,遇强碱会“断路” | |
| C. | 煤经过气化和液化两种物理变化,可变为清洁能源 | |
| D. | 加热能杀死甲型H1N1流感病毒,主要是加热后使病毒中的蛋白质变性 |
17.短周期元素甲、乙、丙、丁的原子序数依次增大,甲的L层电子数是K层的3倍,丁所在族 序数是周期数的2倍,乙、丙、丁的最外层电子数之和为10.下列说法正确的是( )
| A. | 简单离子半径:乙>丙>丁 | |
| B. | 最高价氧化物对应的水化物的碱性:乙>丙 | |
| C. | 简单气态氢化物稳定性:丁>甲 | |
| D. | 甲和丁组成的化合物在熔融状态下可以导电 |
14.用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解液pH下降的是( )
| A. | CuSO4 | B. | NaNO3 | C. | KCl | D. | H2SO4 |
1.一定量的锌粉和2mol•L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2总量的是( )
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥醋酸钠固体.
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥醋酸钠固体.
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑥ | D. | ②⑤⑥ |
11.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 28g乙烯中存在的电子总数为12NA | |
| B. | 标准状况下,22.4LHF的物质的量为1mol | |
| C. | 铅蓄电池电解氯化钠溶液,得到标况下22.4L氢气,理论上铅蓄电池中消耗氢离子个数为4NA | |
| D. | lmol的Na2C03溶于盐酸形成混合溶液1L,常温下在pH=4时,c(CO32- )+c(H2C03)=0.lmol/L |
18.合成具有美白作用的化妆品原料Z的反应原理如下:下列叙述不正确的是( )


| A. | 该反应的反应类型为加成反应 | |
| B. | X、Z均能与Na2CO3溶液反应 | |
| C. | X、Y、Z均能使溴水褪色,且原理相同 | |
| D. | X可作缩聚反应单体,Y可作加聚反应单体 |
16.化学与生产、生活、环境等社会实际密切相关.下列叙述错误的是( )
| A. | 减少机动车尾气的排放,可以降低雾霾的发生 | |
| B. | 垃圾焚烧法已成为许多城市垃圾处理的主要方法之一,利用垃圾焚烧产生的热能发电或供热,能较充分地利用生活垃圾中的生物质能 | |
| C. | 推广使用煤液化技术,可减少二氧化碳等温室气体的排放 | |
| D. | 燃料电池是一种高效、环境友好的发电装置 |

