题目内容
在下列给定条件的各溶液中,一定能大量共存的离子组是( )
| A、含有0.1 mol?L-1 Fe3+的溶液中:K+、Mg2+、SCN-、NO3- | ||
B、室温下
| ||
| C、加入Al能放出H2的溶液中:NH4+、K+、Cl-、HCO3- | ||
| D、在H+、Na+、SO42-浓度均为0.1 mol?L-1的溶液中:K+、SiO32-、Cl-、CH3COO- |
考点:离子共存问题
专题:离子反应专题
分析:A.离子之间结合生成络离子;
B.室温下
=10-13 mol?L-1的溶液,显酸性;
C.加入Al能放出H2的溶液,为非氧化性酸或强碱溶液;
D.离子之间发生复分解反应.
B.室温下
| K W |
| c(H+) |
C.加入Al能放出H2的溶液,为非氧化性酸或强碱溶液;
D.离子之间发生复分解反应.
解答:
解:A.Fe3+、SCN-离子之间结合生成络离子,不能大量共存,故A错误;
B.室温下
=10-13 mol?L-1的溶液,显酸性,该组离子之间不反应,可大量共存,故B正确;
C.加入Al能放出H2的溶液,为非氧化性酸或强碱溶液,酸溶液中不能大量存在HCO3-,碱溶液中不能大量存在NH4+、HCO3-,故C错误;
D.H+、SiO32-结合生成沉淀,H+、CH3COO-离子之间结合生成弱酸,不能大量共存,故D错误;
故选B.
B.室温下
| K W |
| c(H+) |
C.加入Al能放出H2的溶液,为非氧化性酸或强碱溶液,酸溶液中不能大量存在HCO3-,碱溶液中不能大量存在NH4+、HCO3-,故C错误;
D.H+、SiO32-结合生成沉淀,H+、CH3COO-离子之间结合生成弱酸,不能大量共存,故D错误;
故选B.
点评:本题考查离子的共存问题,为高频考点,明确信息及其应用、复分解反应发生的条件、离子之间的络合反应是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
化学键的断裂和形成的观点不能用于解释下列事实中的( )
| A、物质三态变化 |
| B、化学反应的能量变化 |
| C、加成反应 |
| D、化学反应的物质变化 |
室温下,下列各组离子在指定溶液中能大量共存的( )
| A、pH=1的溶液中 K+、CrO42-、SO42-、NH4+ |
| B、饱和氯水中 Cl-、NO3-、Na+、SO32- |
| C、能使pH试纸变红的溶液 NH4+、Na+、SO42-、Fe2+ |
| D、FeCl2溶液中 K+、Na+、SO42-、AlO2- |
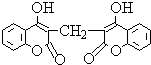 某农民偶然发现他的一头小母牛食用腐败草料后,血液不会凝固.化学家由此得到启发,从腐败草料中提取出结构简式为如图所示的双香豆素.下列关于双香豆素的推论中错误的是( )
某农民偶然发现他的一头小母牛食用腐败草料后,血液不会凝固.化学家由此得到启发,从腐败草料中提取出结构简式为如图所示的双香豆素.下列关于双香豆素的推论中错误的是( )| A、有望将它发展制得一种抗凝血药 |
| B、它无嗅并略具芳香味,因而可用来制备致命性出血型的杀鼠药 |
| C、它可由化合物和甲醛(HCHO)通过缩合反应制得 |
| D、它易溶于水、乙醇、乙醚等有机溶剂 |
下列分离提纯方法不正确的是( )
| A、分离硝酸钾和氯化钠,常用结晶与重结晶 |
| B、提纯含有碘的食盐,常用升华法 |
| C、去除乙醇中的水常用蒸馏法 |
| D、分离苯和四氯化碳可用分液法 |
 所示,该晶胞中含有金属原子的数目为
所示,该晶胞中含有金属原子的数目为