题目内容
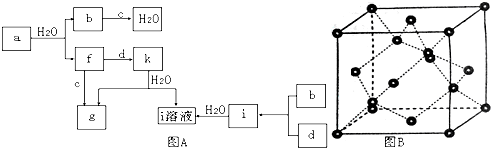
 有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数之和,D 是主族元素且与E同周期,E能形成红色或砖红色E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示.请回答下列问题:
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数之和,D 是主族元素且与E同周期,E能形成红色或砖红色E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示.请回答下列问题:(1)E+离子基态时的电子排布式为
(2)A2F的分子空间构型为
(3)CA3极易溶于水,其原因主要是
(4)从图中可以看出,D 与B形成的离子化合物的化学式为
(5)已知E单质的晶体为面心立方最密堆积(在晶胞的顶点和面心均含有一个E原子),则E的晶体中E原子的配位数为
考点:位置结构性质的相互关系应用,晶胞的计算
专题:元素周期律与元素周期表专题
分析:有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,则A为H元素;B是电负性最大的元素,则B为F元素;C的2p轨道中有三个未成对的单电子,原子核外电子排布为1s22s22p3,则C为N元素;F原子核外电子数是B与C核外电子数之和,则F原子核外电子数为9+7=16,则F为S元素;E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,则E为Cu元素;D与B可形成离子化合物,根据晶胞结构可知,晶胞中F原子数目为8,D原子数目为8×
+6×
=4,故化学式为DF2,D为+2价,D是主族元素且与E同周期,处于第四周期,则D为Ca元素,据此解答.
| 1 |
| 8 |
| 1 |
| 2 |
解答:
解:有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,则A为H元素;B是电负性最大的元素,则B为F元素;C的2p轨道中有三个未成对的单电子,原子核外电子排布为1s22s22p3,则C为N元素;F原子核外电子数是B与C核外电子数之和,则F原子核外电子数为9+7=16,则F为S元素;E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,则E为Cu元素;D与B可形成离子化合物,根据晶胞结构可知,晶胞中F原子数目为8,D原子数目为8×
+6×
=4,故化学式为DF2,D为+2价,D是主族元素且与E同周期,处于第四周期,则D为Ca元素,
(1)E为Cu元素,Cu+离子基态时电子排布式为1s22s22p63s23p63d10,
故答案为:1s22s22p63s23p63d10;
(2)H2S分子中S原子的价层电子对数=2+
=4,S原子采取sp3杂化,S的氧化物SO3分子中S原子价层电子对数=3+
=3,S原子没有孤对电子,故SO3为平面正三角形,
故答案为:sp3;平面正三角形;
(3)NH3极易溶于水,其原因主要是NH3与水分子间形成氢键,
故答案为:NH3与水分子间形成氢键;
(4)D与F元素可形成离子化合物,根据晶胞结构可知,晶胞中F原子数目为8,D原子数目为8×
+6×
=4,故化学式为DF2,D为+2价,D是主族元素且与E同周期,处于第四周期,则D为Ca元素,故该离子化合物化学式为CaF2,晶胞的密度为ag?cm-3,晶胞的质量为
,故晶胞的体积为
=
cm3,
故答案为:CaF2;
cm3;
(5)Cu单质的晶体为面心立方最密堆积,以顶点Cu原子研究,与之最近的Cu原子处于面心上,每个顶点为12个面共用,故Cu的配位数为12,
故答案为:12.
| 1 |
| 8 |
| 1 |
| 2 |
(1)E为Cu元素,Cu+离子基态时电子排布式为1s22s22p63s23p63d10,
故答案为:1s22s22p63s23p63d10;
(2)H2S分子中S原子的价层电子对数=2+
| 6-2 |
| 2 |
| 6-2×3 |
| 2 |
故答案为:sp3;平面正三角形;
(3)NH3极易溶于水,其原因主要是NH3与水分子间形成氢键,
故答案为:NH3与水分子间形成氢键;
(4)D与F元素可形成离子化合物,根据晶胞结构可知,晶胞中F原子数目为8,D原子数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 4×78g/mol |
| NAmol-1 |
| ||
| a g?cm-3 |
| 4×78 |
| a×NA |
故答案为:CaF2;
| 4×78 |
| a×NA |
(5)Cu单质的晶体为面心立方最密堆积,以顶点Cu原子研究,与之最近的Cu原子处于面心上,每个顶点为12个面共用,故Cu的配位数为12,
故答案为:12.
点评:本题以元素推断为载体,综合考查物质结构与性质,涉及核外电子排布规律、杂化理论与分子结构、氢键、晶胞计算等,难度中等,(4)注意利用均摊法进行晶胞计算.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
下列实验操作不正确的是( )
| A、用浓硫酸配制一定浓度的稀硫酸时,用量筒量取浓硫酸倒入盛水的烧杯中稀释,且用水洗涤量筒,洗涤液一并注入烧杯 |
| B、除去Fe(OH)3胶体中混有的Cl-离子,可用渗析的方法 |
| C、用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 |
| D、NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |
NA表示阿佛加德罗常数,下列说法正确的是( )
A、18g NH
| ||
| B、1mol 任何气体的体积都约是22.4L | ||
| C、NA个H2SO4分子的质量等于H3PO4的摩尔质量 | ||
| D、标准状况下,相同体积的O2、HCl、H2O含有的分子数相同 |
下列判断错误的是( )
| A、非金属氧化物不一定是酸性氧化物,金属氧化物不一定为碱性氧化物 |
| B、联合制碱法在滤出NaHCO3后,为使滤液中NH4Cl析出更多更纯,通氨气加食盐冷却 |
| C、发生化学反应时失去电子数越多的金属原子,还原能力不一定越强 |
| D、氯水、Na2O2、活性炭都能使品红溶液褪色,但原理彼此都不相同 |