题目内容
下列说法正确的是( )
| A、同周期随着序号增大电离能渐大 |
| B、同周期随着序号增大电负性渐小 |
| C、同周期随序号增大熔沸点渐大 |
| D、同周期随序号增大非金属渐强 |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A.同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素;
B.同一周期元素,元素的电负性随着原子序数增大而增大;
C.元素的熔沸点在同一主族中具有可比性,同周期无规则变化规律;
D.同周期随序号增大非金属渐强,金属性渐弱.
B.同一周期元素,元素的电负性随着原子序数增大而增大;
C.元素的熔沸点在同一主族中具有可比性,同周期无规则变化规律;
D.同周期随序号增大非金属渐强,金属性渐弱.
解答:
解:A.元素越容易失电子,则元素的电离能越小,同一周期元素,元素失电子能力逐渐减小,所以元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素,故A错误;
B.元素得电子能力越大,其电负性越大,同一周期元素,得电子能力逐渐增大,所以元素的电负性随着原子序数增大而增大,故B错误;
C.元素的熔沸点在同一主族中具有可比性,同周期无规则变化规律,故C错误;
D.同周期随序号增大非金属渐强,金属性渐渐减弱,故D正确,
故选D.
B.元素得电子能力越大,其电负性越大,同一周期元素,得电子能力逐渐增大,所以元素的电负性随着原子序数增大而增大,故B错误;
C.元素的熔沸点在同一主族中具有可比性,同周期无规则变化规律,故C错误;
D.同周期随序号增大非金属渐强,金属性渐渐减弱,故D正确,
故选D.
点评:本题考查了元素周期表和元素周期律综合应用,灵活利用同一周期、同一主族元素周期律来分析解答,题目难度不大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
下列各组离子一定能大量共存的是( )
| A、在含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
| B、在能与Si反应产生H2的溶液中:NH4+、K+、SO32-、NO3- |
| C、在能与Al反应产生H2的溶液中:NH4+、Al3+、SO42-、NO3- |
| D、在pH=1的溶液中:K+、Fe3+、Cl-、NO3- |
对酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+)分别进行如下实验
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸.对于下列物质不能确认其在溶液中是否存在的是 ( )
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸.对于下列物质不能确认其在溶液中是否存在的是 ( )
| A、H2SO3 |
| B、SO42- |
| C、NH4+ |
| D、Br |
下列各项中,用来表示物质的组成或结构的模型是( )


| A、①②③④ | B、①和② |
| C、③和④ | D、只有① |
 有100mL NaOH溶液,现向其中逐渐通入一定量的CO2,随后向此溶液中逐滴加入4mol/L的盐酸溶液,产生的CO2气体体积(标准状况下)与所加入盐酸溶液的体积之间的关系如图所示,试求:
有100mL NaOH溶液,现向其中逐渐通入一定量的CO2,随后向此溶液中逐滴加入4mol/L的盐酸溶液,产生的CO2气体体积(标准状况下)与所加入盐酸溶液的体积之间的关系如图所示,试求: (提示:环丁烷
(提示:环丁烷 可简写成
可简写成 )
)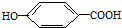 ),其反应类型
),其反应类型

 (g)
(g) (g)+3H2(g)
(g)+3H2(g)