题目内容
2NO2(g)?N2O4(g)△H=-56.9kJ/mol,2mol NO2转化为N2O4时放出的热量( )
| A、大于56.9 kJ |
| B、小于56.9 kJ |
| C、等于56.9 kJ |
| D、不能确定 |
考点:化学反应的可逆性
专题:化学平衡专题
分析:热化学方程式2NO2(g)?N2O4(g)△H=-56.9kJ/mol表示的意义是2molNO2完全放出的热量是56.9KJ,而可逆反应不可能进行彻底.
解答:
解:热化学方程式2NO2(g)?N2O4(g)△H=-56.9kJ/mol表示的意义是2molNO2完全放出的热量是56.9KJ,而可逆反应不可能进行彻底,即2molNO2不可能完全反应,所以放出的热量会小于56.9KJ,故选:B.
点评:本题通过根据热化学反应方程式计算放出的热量问题考查了可逆反应的特点,即不能进行到底,反应物和生成物共存.

练习册系列答案
相关题目
在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)?2SO3(g)△H<0,某研究小组探究其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是( )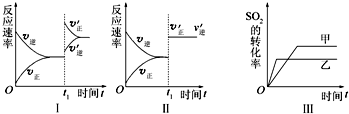

| A、图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B、图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C、图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高 |
| D、图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
下列各组离子,在强碱性溶液中可以大量共存的是( )
| A、Na+、Br-、Cl-、S2- |
| B、Na+、K+、NH4+、Ba2+ |
| C、Ca2+、K+、Cl-、CO32- |
| D、SO32-、NO3-、SO42-、HCO3- |
能证明醋酸是一种弱酸的事实是( )
| A、醋酸溶液能跟钠反应放出H2 |
| B、1mol/L醋酸溶液的pH小于7 |
| C、1mol/L醋酸钠溶液的pH约为9 |
| D、pH=5醋酸稀释100倍后7>pH>5 |
已知M2O7x-+3S2-+14H+=2M3++3S↓+yH2O,则M2O7x-中的M的化合价为( )
| A、+6 | B、+4 | C、+3 | D、+2 |
已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量,②1mol I2蒸气中化学键断裂时需要吸收151kJ的能量,③由H原子和I原子形成1mol HI分子时释放299kJ的能量.下列热化学方程式正确的是( )
| A、2HI(g)═H2(g)+I2(g)△H=+11kJ/mol | ||||
B、
| ||||
| C、H2(g)+I2(g)═2HI(g)△H=+288kJ/mol | ||||
D、
|
下列电离方程式书写正确的是( )
| A、BaSO4?Ba2++SO42- |
| B、H3PO4?3H++PO43- |
| C、Al(OH)3?H++AlO2-+H2O |
| D、NaHS=Na++H++S2- |