题目内容
对于可逆反应A(g)+2B(g)?2C(g)△H>0,下列图象中正确的是( )
A、 |
B、 |
C、 |
D、 |
考点:化学平衡的影响因素
专题:图示题,化学平衡专题
分析:可逆反应A(g)+2B(g)?2C(g)△H>0,反应物气体的化学计量数之和大于生成物气体的化学计量数,增大压强,平衡向正反应方向移动,正反应吸热,升高温度平衡向正反应方向移动,以此解答该题.
解答:
解:A.增大压强,平衡向正反应方向移动,正反应速率大于逆反应速率,故A错误;
B.正反应吸热,升高温度平衡向正反应方向移动,A的百分含量减小,故B错误;
C.升高温度,反应速率增大,达到平衡所用时间较少,图象不符合,故C错误;
D.升高温度,反应速率增大,达到平衡所用时间较少,平衡向正反应方向移动,A的含量减小,故D正确.
故选D.
B.正反应吸热,升高温度平衡向正反应方向移动,A的百分含量减小,故B错误;
C.升高温度,反应速率增大,达到平衡所用时间较少,图象不符合,故C错误;
D.升高温度,反应速率增大,达到平衡所用时间较少,平衡向正反应方向移动,A的含量减小,故D正确.
故选D.
点评:本题考查化学反应平衡图象问题,题目难度中等,注意分析方程式的特征来判断温度、压强对平衡移动的影响为解答该题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某工业生产经过以下转化步骤:
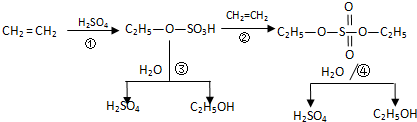
下列说法中不正确的是( )

下列说法中不正确的是( )
| A、该过程中③、④是酯类的水解反应 |
| B、该过程中硫酸是催化剂 |
| C、该过程中①、②是加成反应 |
| D、该过程是一种新的硫酸生产方法 |
短周期元素X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为14;X原子的内层电子数与Y原子的最外层电子数相等;X原子的核外电子总数与Z原子的最外层电子数相等.下列说法正确的是( )
| A、X的氧化物都能与水反应生成酸 |
| B、Z的离子半径比Y的离子半径小 |
| C、Y和Z组成的化合物是离子化合物 |
| D、X的气态氢化物分子与Z的离子具有相同的电子数 |
N2H4是常用的火箭高能燃料,与H2O2混合可做液体推进剂,反应为:N2H4+2H2O2═N2+4H2O,下列有关说法中正确的是( )
| A、N2H4分子中既存在极性键,又存在离子键 |
B、H2O2分子的电子式为: |
| C、28g N2中含有π键数目为2NA |
D、水分子的球棍模型 |
下列各组溶液,同时开始反应,出现浑浊最早的是( )
| A、20℃时5mL 0.05mol?L-1 Na2S2O3溶液与5mL 0.1mol?L-1硫酸混合 |
| B、20℃时 50mL0.1mol/L Na2S2O3溶液与50mL 0.1mol?L-1硫酸混合 |
| C、10℃时5mL 0.05mol?L-1 Na2S2O3溶液与5mL 0.1mol?L-1硫酸混合 |
| D、10℃时 5mL 0.1mol?L-1 Na2S2O3溶液与5mL 0.1mol?L-1硫酸混合 |
为达到下列实验目的,所采用的方法正确的是( )
| A、分离饱和食盐水和沙子的混合物------过滤 |
| B、分离水和汽油的混合物------蒸馏 |
| C、从硝酸钾和氯化钾混合液中获取硝酸钾-----蒸发 |
| D、从溴水中提取溴------分液 |
在b L FeBr2溶液中通入a mol Cl2时,使溶液中30%的Br-氧化为Br2,则原FeBr2的物质的量浓度为( )
A、0.25
| ||
B、0.5
| ||
C、1.0
| ||
D、1.25
|
某化合物6.4g完全燃烧,只生成8.8克CO2和7.2克H2O.下列说法正确的是( )
| A、该化合物仅含碳、氢两种元素 |
| B、无法确定该化合物是否含有氧无素 |
| C、该化合物中一定含有氧元素 |
| D、该化合物中碳、氢原子个数比为1:2 |
根据如图信息判断,下列叙述正确的是( )


| A、硝酸钾的溶解度随温度升高而减小 |
| B、t2℃时,100g饱和硝酸钾溶液中溶有硝酸钾85g |
| C、t1℃时,氯化钠和硝酸钾的溶解度相同 |
| D、将t1℃时的硝酸钾饱和溶液升温到t2℃,有晶体析出 |